
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РОЗЧИНИ 2 страница
|
|
|
|
а) мірна колба; б) піпетка;
в) бюретка; г) стакан.
1.5.63. Забарвлення метилоранжу в кислому середовищі:
а) рожевий; б) жовтий;
в) безбарвний.
1.5.64. Забарвлення метилоранжу в лужному середовищі
а) рожевий; б) жовтий;
в) безбарвний.
1.5.65. Інтервал переходу забарвлення метилоранжу:
а) 3,1-4,4; б) 8,2-10,0;
в) 4,0-10,0.
1.5.66. Фенолфталеїн в кислому середовищі:
а) рожевий; б) малиновий;
в) безбарвний.
1.5.67. Фенолфталеїн в лужному середовищі має забарвлення:
а) рожеве; б) малинове; в) безбарвний.
1.5.68. Інтервал переходу забарвлення індикатора фенолфталеїна:
а) 3,1-4,4; б) 3,1-8,2; в) 8,2-10,0.
1.5.69. Яка реакція лежить в основі кислотно-основного титрування:
а) окиснення; б) осадження; в) нейтралізації.
1.5.70. Основне рівняння методу нейтралізації:
а) [Н+] + [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.
1.5.71. Робочі розчини в методі нейтралізації:
а) Н2С2О4⋅2Н2О, Н2SO4, NaOH, KOH;
б) Н2SO4, HCl, Na2CO3, NaOH;
в) NaOH, KOH, Н2SO4, HCl.
1.5.72. Методом нейтралізації можна визначати:
а) кислоти, відновники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.73. Класи сполук, які визначаються методом кислотно-основного титрування:
а) кислоти, основи, окисники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.74. Криві титрування – це:
а) зміна забарвлення розчину в процесі титрування;
б) графічне зображення зміни реакції середовища в процесі титрування;
в) зміна об’єму розчинів в процесі титрування.
1.5.75. Криві титрування показують:
а) зміну об’ємів розчинів при титруванні;
б) залежність рН системи від зміни об’єму титрованого розчину;
в) графічне зображення зміни індикатора.
1.5.76. Стрибок титрування – це:
а) різка зміна рН під час титрування; б) різка зміна рН поблизу еквівалентної точки;
в) момент кінця реакції.
1.5.77. Еквівалентна точка – це:
а) точка кінця реакції;
б) рН, за якого сполуки прореагували в рівних кількостях;
в) рН, за якого сполуки прореагували в еквівалентних кількостях.
1.5.78. Основне рівняння методу ацидіметрії:
а) [Н+] / [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.
1.6. КИСЛОТНО-ОСНОВНІ РІВНОВАГИ. рН.
1.6.1. Які з перелічених груп речовин відносять тільки до елекролітів:
а) NaCl, CaCl2, KOH;
б) KOH, C2H5OH, NaCl;
в) Na2B4O7 10H2O, HCOOH, NaCl.
г) C6H12O6, C2H5OH, H2SO4.
1.6. 2. Які з перелічених груп речовин відносять тільки до неелектролітів:
а) C6H12O6, C2H5OH;
б), KCl, C2H5OH;
в) NaCl H2SO4;
г) С12Н22О11, СН3СНСООН.
1.6. 3. Які із наведених речовин відносять до слабких електролітів?
а) NaCl, б) CH3COOH;
в) Na2SO4; г) HCl.
1.6.4. Які із наведених речовин відносять до слабких електролітів?
а) Н2О, б) NaCl;
в) HCl; г)CCl3COOH.
1.6.5. Які із наведених речовин відносять до слабких електролітів?
а) C2H5OH, б) CCl3COOH;
в) NaCl; г) H2SO4.
1.6.6. Які із наведених речовин відносять до cильних електролітів?
а) NaCl; б) BaSO4;
в) Ca3(PO4)2; г) H2O.
1.6.7. Які із наведених речовин відносять до cильних електролітів?
а) BaSO4; б) H2O;
в) MgCl2; г) H2O.
1.6.8. Які із наведених речовин відносять до cильних електролітів?
а) CaCl2; б) CaCO3;
в) Ca3(PO4)2; г) AgCl.
1.6.9. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (іонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.10. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (йонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.11. Водневий показник записується як вираз:
а) [H+]; б) [OH-]; в) pH; г) pOH.
1.6.12. Як записати йонний добуток води?
а) [H3O+]*[OH-]=10-14 б) 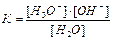
в) 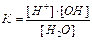
 г)
г) 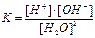
1.6.13. Яка формула використовується для розрахунку рН розбавленого розчину HCl?
а) рН = -ℓg[Н+]; б) рН = 14 – рОН;
в) рН = - ℓgСОН- г) рН = -ℓg[Н+]∙2
1.6.14. Закон розведення Оствальда можна виразити:
а) 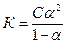 б)
б) 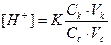
в) Р=СRT; г) рН=14-рОН
1.6.15. Яке значення рН в кислих розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.16. Яке значення рН в лужних розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.17. Ступінь дисоціації (α) для слабких електролітів при с (електроліту) = 0,1 моль/л за температури 250С має значення:
а) α=0; б) α<1; в) α<0,1; г) α<0,03.
1.6.18. Що таке ацидоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) розрідження крові внаслідок плазмолізу;
в) зміщення рН середовища в організмі у кислу сторону;
г) підвищене згортання крові.
1.6.19. Що таке алкалоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) підвищення чутливості організму до окремих ліків;
в) підвищення згортання крові;
г) нервове збудження.
1.6.20. Ацидоз – це відхилення рН крові до:
а) 8,3; б) 8,0; в) 7,2; г) 7,5.
1.6.21 Алкалоз – це відхилення рН крові до:
а) 6,5; б) 6,8; в) 7,1; г) 7,5.
1.6.22. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) і зменшення резервної лужності називають:
а) анабіозом; б) алкалозом;
в) ацидозом; г) антагонізмом.
1.6.23. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) і збільшення резервної лужності називається:
а) анабіозом; б) ацидозом;
в) алкалозом; г) антагонізмом.
1.6.24. Вибрати рівняння гідролізу соди і рН середовища в розчині
а) H2SO4 + NaOH → рН=7
б) HCl + Na2CO3 → рН<7
в) H2CO3 + NaOH → рН<7
г) H2O + Na2CO3 → рН>7
1.6.25. Міра активної кислотності середовища:
а) ступінь дисоціації;
б) константа дисоціації;
в) рН розчину;
г) об’єм 0,1 М розчину NaOH, затраченого на титрування.
1.6.26. Що таке активна кислотність?
а) ступінь дисоціації кислоти;
б) концентрація йонів Н+ в розчині;
в) константа дисоціації кислоти;
г) відтитрована кислотність середовища.
1.6.27. Інтервал рН, що відповідає поняттю «підвищена» кислотність шлункового соку:
а) рН=0,9; б) рН<1,9; в) рН<4,5; г) рН=7.
1.6.28. Чи одинакові активна і загальна кислотність у розчині сульфатної кислоти
а) так, б) ні, активна більша;
в) ні, загальна більша; г) ні, активна менша.
1.6.29. Чи одинакова активна і загальна кислотність у розчині HCl?
а) ні; б) більша активна;
в) так; г) більша загальна.
1.6.30. Чи однакові активна і загальна кислотність у розчині оцтової кислоти?
а) загальна менша; б) активна менша;
в) активна набагато більша; г) так.
1.6.31. Імовірне значення рН крові людини в нормі:
а) рН=7; б) рН=7,2;
в) рН=7,36; г) рН=7,56.
1.6.32. Яке порушення кислотно-лужної рівноваги може наступити, якщо рН плазми крові стане 7,55?
а) кислотність зросте; б) наступить алкалоз;
в) наступить ацидоз; г) відбудеться плазмоліз.
1.6.33. Імовірні границі зміни значення рН слини:
а) 6,5-7,5; б) 5.6-7,9;
в) 6,0-8,6 г) 7,0-8,6.
1.6.34. Значення рН сечі людини знаходиться в межах:
а) 4,8 – 5,8; б) 6,5 – 8,5;
в) 2,2 – 5,0; г) 5,0 – 6,5.
1.6.35. Фізіологічне значення рН сечі:
а) 1-3; б) 3-6; в) 5-8; г) 6-9.
1.6.36. Можливі границі зміни рН сльозової рідини:
а) 7,6-7,8; б) 7,0-7,6;
в) 7,7-8,7 г) 8,0-8,7.
1.6.37. Чому дорівнює в середньому рН слини в нормі:
а) 5,0; б) 6,75; в) 7,75; г) 8,25.
1.6.38. Імовірне значення рН шлункового соку в нормі:
а) 0,6; б) 1,05; в) 1,65; г) 2,05.
1.6.39. Інтервал рН, що відповідає поняттю «знижена» кислотність шлункового соку:
а) рН > 7,36; б) рН > 0,9;
в) рН > 1,65; г) рН > 2,0.
1.6.40. Інтервал рН, що відповідає поняттю «нульова» кислотність шлункового соку:
а) рН > 7; б) рН >1,65;
в) рН > 1,0; г) рН > 2,0.
1.6.41. Концентрація йонів гідроксилу 0,0001 моль/л. Яке рН розчину?
а) 10; б) 9; в) 4; г) 5.
1.6.42. Концентрація йонів водню в розчині Сн+= 0,001 моль/л. Підрахувати рН розчину.
а) рН=0,0001; б) рН=0,1;
в) рН=2; г) рН=3.
1.6.43. Знайти концентрацію ОН-йонів у морській воді, якщо її рН = 8,0.
а) [ОН-] = 1*10-8 б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-4; г) [ОН-] = 1*10-2.
1.6.44. Розрахувати концентрацію йонів водню у розчині сульфатної кислоти, якщо рН = 2. Навести розрахунки.
а) [H+] = 0,1; б) [H+] = 0,01;
в) [H+] = 0,2; г) [H+] = 0,02.
1.6.45. Визначити концентрацію йонів водню в слині, якщо рН=6,0. Навести розрахунок.
а) [H+] = 6,0; б) [H+] = 106;
в) [H+] = 10-6; г) [H+] = 1*106.
1.6.46. Розрахувати концентрацію [ОН-]-йонів у питній воді, якщо її рН = 6. Навести розрахунки.
а) [ОН-] = 0,003; б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-8; г) [ОН-] = 0,6.
1.6.47. Після тривалої роботи в гарячому цеху у робочого відмічено підвищення температури тіла до 38,5°С, тахікардія, порушення ритму сердечних скорочень. Переважно втрата якого електроліту призводить до порушення роботи серця?
а) калію; б) кальцію;
в) магнію; г) фосфору.
1.6.48. Ступінь дисоціації аміаку збільшується при:
а) Розведенні розчину;
б) Охолодженні розчину;
в) Концентруванні розчину;
г) Додаванні солі амонію;
1.6.49. Водневий показник 0,01 М розчину HCl дорівнює:
а) 2; б) 3; в) 5; г)4.
1.6.50. Водневий показник 0,001 Н розчину KOH дорівнює:
а) 11; б) 13; в) 10; г) 12
1.6.51. Водневий показник 0,01 Н розчину слабкої одноосновної кислоти (ступінь дисоціації 1\%) дорівнює:
а) 4; б) 2; в) 1; г) 3
1.6.52. Водневий показник 0,001 М слабкої однокислотної основи (ступінь дисоціації 1\%) дорівнює:
а) 9; б) 8; в) 10 г) 13
1.6.53. Водневий показник 0,05 М розчину H2SO4 дорівнює:
а) 1; б) 2; в) 5; г) 4
1.6.54. Водневий показник 0,001 М розчину хлоридної кислоти дорівнює:
а) 3; б) 0; в) 10; г) 7
1.6.55. Іонний добуток води – це:
а) сума концентрацій протонів та гідроксид-іонів;
б) добуток концентрацій протонів та гідроксид-іонів;
в) відношення концентрацій протонів та гідроксид-іонів.
1.6.56. За рН = 2 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-14 моль/ л;
в) 10-12моль/л.
1.6.57. За рН = 11 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-11 моль/ л;
в) 10-14 моль/л.
1.6.58..Активна кислотність – це:
а) концентрація кислоти;
б) концентрація кислотного залишку;
в) концентрація протонів.
г) концентрація гідроксидних йонів
1.6.59. Потенціальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) концентрація кислоти;
в) концентрація іонів гідрогену.
1.6.60. Загальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) загальна концентрація кислоти;
в) концентрація протонів.
1.6.61. Титруванням визначають:
а) активну кислотність; б) потенціальну кислотність; в) загальну кислотність.
1.6.62. Формула обчислення рН розчину сильної кислоти:
а) рН = – lg Кд [кислоти]; б) рН = – lg [кислоти]; в) рН = – lgα – [кислоти].
1.6.63.Формула обчислення рН розчину слабкої кислоти:
а) pH =−lg Кд ⋅[кислоти];
б) рН = – lg [кислоти];
в) рН = – lg К д · [кислоти].
1.6.64.рОН – це:
а) натуральний логарифм концентрації лугу.
б) від’ємний десятковий логарифм концентрації гідроксид–іонів;
в) від’ємний десятковий логарифм концентрації основи.
1.6.65. Пепсин шлункового соку діє у:
а) кислому середовищі; б) лужному середовищі; в) нейтральному середовищі.
1.6.66.рН венозної крові:
а) більший за рН артеріальної крові;
б) менший за рН артеріальної крові;
в) однаковий із рН артеріальної крові.
1.6.67. рН в клітині:
а) менший за рН крові; б) більший за рН крові; в) однаковий із рН крові.
1.6.68..рН 0,001 М NaOH становить:
а) 3; б) 11; в) 6.
1.6.69. рОН 0,01М розчину КОН:
а) 12; б) 2; в) 7.
1.7. ГІДРОЛІЗ СОЛЕЙ
1.7.1. Гідроліз солі – це реакція взаємодії солі з водою, в результаті якої:
а) порушується рівновага дисоціації води, утворюється слабкий електроліт і, як правило, змінюється кислотність середовища;
б) утворюються сильні електроліти, змінюється кислотність середовища;
в) кислотність середовища не змінюється, утворюються сильні електроліти;
г) не порушується рівновага дисоціації води;
д) утворюється газ або осад, не змінюється кислотність середовища.
1.7.2. Посилення гідролізу солей при підвищенні температури пояснюється:
а) збільшенням швидкості ендотермічної реакції дисоціації води;
б) зменшенням швидкості ендотермічної реакції дисоціації води;
в) зменшенням швидкості екзотермічної реакції дисоціації води;
г) додавання СН3СООН;
д) збільшенням швидкості екзотермічної реакції дисоціації води.
1.7.3. Константа гідролізу (Кr) солі слабкої кислоти і сильної основи або слабкої основи і сильної кислоти – це відношення іонного добутку води (Кв) до:
а) константи дисоціації слабкого електроліту;
б) суми молярних концентрацій іонів гідрогену та гідроксиду;
в) добутку молярних концентрацій іонів гідрогену та гідроксиду;
г) кількості речовин солі, що прогідролізувала;
д) кількості речовин солі, що продесоціювала.
1.7.4. Ступінь гідролізу солі (αr) – це відношення до загальної кількості речовини розчиненої солі:
а) молярної концентрації солі;
б) масової концентрації солі;
в) масової частки солі;
г) кількості речовин солі, що прогідролізувала;
д) кількості речовин солі, що продесоціювала.
1.7.5. Ступінь гідролізу солі (αr) зростає при:
а) збільшенні концентрації солі;
б) зниженні температури;
в) зниженні температури та збільшенні концентрації солі;
г)зменшенні концентрації солі;
д) додаванні солі, утвореної сильною кислотою та лугом.
1.7.6. Вказати, яка дія змістить рівновагу гідролізу натрій ацетату вліво:
а) підвищення температури;
б) додавання натрій ацетату;
в) додавання води;
г) додавання СН3СООН;
д) додаванні солі, утвореної сильною кислотою та лугом.
1.7.7. Гідролізу не підлягають солі, утворені:
а) слабкою кислотою та сильною основою (лугом);
б) слабкою основою та сильною кислотою;
в) сильною кислотою та сильною основою (лугом);
г) слабкою кислотою та слабкою основою;
д) кислим залишком та катіоном металу.
1.7.8. Назвати водний розчин електроліту, що має найменше значення рН:
а) NaCl; б) KCl; в) CaCl2;
г) NH4Cl; д) BaCl2.
1.7.9. Із наведених нижче солей виберіть ту, що зазнає гідролізу:
а) ферум (ІІІ) нітрат; б) барій хлорид;
в) аргентум бромід; г) калій нітрат;
д) натрій сульфат.
1.7.10. Із наведених нижче солей виберіть ту, що зазнає гідролізу:
а) ферум (ІІ) хлорид; б) барій хлорид;
в) аргентум хлорид; г) калій хлорид;
д) натрій хлорид.
1.7.11. Із наведених нижче солей виберіть ту, водний розчин якої слабкокислий:
а) хром (ІІІ) сульфат; б) барій хлорат;
в) натрій карбонат; г) натрій хлорат;
д) калій перхлорат.
1.7.12. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний:
а) калій нітрат; б) калій сульфат;
в) калій хлорат; г) калій сульфід;
д) калій бромід.
1.7.13. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний:
а) калій сульфат; б) калій сульфіт;
в) аргентум нітрат; г) барій сульфат;
д) натрій хлорид.
1.7.14. Із наведених нижче солей виберіть ту, водний розчин якої лужний:
а) натрій сульфат; б) натрій ціанід;
в) аргентум нітрат; г) натрій нітрат;
д) натрій бромід.
1.7.15. Яка із наведених солей не гідролізує:
а) AlPO4; б) AlCl3; в) Al2(SO4)3;
г) Al(NO3)3; д) Al2S3.
1.7.16. Яка реакція середовища сечі, якщо аналізи показали, що в ній містяться такі солі: NH4Cl, NH4Н2PO4, (NH4)2SO4:
а) кисла; б) лужна; в) нейтральна;
г) слабколужна; д) слабкокисла.
1.7.17. Реакція середовища при гідролізі солі, утвореної слабкою кислотою та сильною основою (лугом), буде:
а) нейтральна; б) слабкокисла;
в) кисла; г) лужна; д) слабколужна.
1.7.18. Реакція середовища при гідролізі солі, утвореної слабкою основою та слабкою кислотою, якщо Кд(основи)> Кд(кислоти) буде:
а) лужна; б) нейтральна; в) кисла
г) слабколужна; д)слабкокисла.
1.7.19. Реакція середовища при гідролізі солі, утвореної слабкою основою та слабкою кислотою, якщо Кд(основи)< Кд(кислоти) буде:
а) лужна; б) нейтральна; в) кисла;
г) слабкокисла; д) слабколужна.
1.7.20. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та лугом:
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.21. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою основою та сильною кислотою:
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.22. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо Кд(основи)> Кд(кислоти):
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.23. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо Кд(основи)= Кд(кислоти):
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.24. Вкажіть, яка із наведених солей підлягає повному незворотньому гідролізу:
а) Cr2S3; б) Al2(SO4)3;
в) Cr(NO3)3; г) KNO3
1.7.25. Яка із наведених солей внаслідок зворотнього гідролізу дає лужне середовище?
а) Na2CO3; б) KCl;
в) AlCl3; г) NaNO3
1.7.25. Яка із наведених солей внаслідок зворотнього гідролізу дає кисле середовище?
а) Fe(NO3)3; б) K2CO3;
в) NaI; г) K3PO4.
1.7.26. Який із наведених оксидів є ангідридом нітратної кислоти?
а) N2O5; б) N2O3;
в) NO2; г) NO.
1.7.27. Вкажіть колір лакмусу у розчині нітрату заліза (III):
а) червоний; б) Фіолетовий;
в) Синій; г) Малиновий
1.7.28. Вкажіть колір лакмусу у розчині карбонату натрію:
а) синій; б) Фіолетовий;
в) Червоний; г) Малиновий.
1.7.29. Вкажіть колір метилоранжу в розчині сульфату цинку:
а) рожевий; б) Жовтий;
в) Оранжевий; г) Червоний
1.7.30. Вкажіть колір метилоранжу в розчині карбонату калію:
а) жовтий; б) Оранжевий;
в) Рожевий; г) Безбарвний
1.7.30. Вкажіть колір фенолфталеїну у розчині хлориду алюмінію:
а) безбарвний; б) Малиновий;
в) Жовтий; г) Синій
1.7.31. Вкажіть колір фенолфталеіну в розчині ортофосфату калію:
а) малиновий; б) Безбарвний
в) Червоний; в) Синій
1.7.32. Вкажіть колір метилового червоного у розчині сульфату хрому (III):
а) червоний; б) Жовтий;
в) Синій; в) Безбарвний
1.7.33. Вкажіть, яка із вказаних солей не піддається гідролізу:
а) Ba(NO3)2; б) ZnCl2
в) KNO2; г) K2HPO4
1.7.34. При розчиненні у воді якої із солей амонію, середовище залишиться практично нейтральним?
а) CH3COO NH4; б) (NH4)2SO4;
в) NH4Cl; г) NH4NO3.
1.7.35. Виходячи зі значень добутків розчинності [ДР], вкажіть, у якій з реакцій можно повно осадити катіони Ca2+ з розчину
а) Ca2+ + 2F- = CaF2 ДР [CaF2] = 4,0·10 -11;
б) Ca2+ + SO42- = CaSO4 ДР [CaF2] = 9,1·10 -8
в) Ca2+ + CO32- = CaCO3 ДР [CaCO3] = 4,8·10 -9
г) Ca2+ + C2O42- = CaC2O4 ДР [CaC2O4] = 3,8·10-9
1.7.36. Яка з наведених солей не піддається гідролізу
а) K2SO4; б) K2SO3;
в) AlBr3; г) CuSO4
1.7.37. Гідроліз яких солей перебігає в одну стадію без зворотності процесу
а) Cr2S3; б) Na2S;
в) CuS; г) AlCl3
нічого з переліченого
1.7.38. Вкажіть сіль, розчин якої має лужну реакцію:
а) Na2S; б) Na2SO4;
в) KCl; г) CuCl2.
1.7.39. Додавання якої речовини зменшить ступінь гідролізу солі CuSO4?
а) H2SO4; б) H2O;
в) KOH; г) Na2CO3.
1.7.40. Із перелічених нижче нітратів гідролізу піддається:
а) NH4NO3; б) Sr(NO3)2
в) NaNO3; г) KNO3
1.7.41. Серед наведених сполук вкажіть сіль, водний розчин якої має кисле середовище:
а) ZnSO4; б) Na2B4O7;
в) Na3PO4; г) NaCl
1.8. БУФЕРНІ РОЗЧИНИ
1.8.1. Характерною властивістю буферних систем є:
а) постійність величини рН при розведенні або при додаванні невеликої кількості кислоти чи лугу;
б) незначна зміна значення рН при додаванні невеликої кількості кислоти;
в) зміна значення рН при розведенні;
г) незначна зміна рН додаванні невеликої кількості лугу.
1.8.2. Як впливає розведення буферних систем на значення рН:
а) не впливає; б) майже не змінює;
в) змінює значення рН в сторону кислого середовища;
г) змінює значення рН в сторону лужного середовища.
1.8.3. Величина рН буферних систем залежить:
а) від константи дисоціації слабкого електроліту і від співвідношення компонентів;
б) від співвідношення компонентів і температури;
в). від константи іонізації і не залежить від співвідношення компонентів;
г) від константи дисоціації і не залежить від тиску.
1.8.4. Для розрахунку рН буферного розчину необхідно знати:
а) константу дисоціації і співвідношення кислота: сіль:
б) тиск і температуру;
в) константу дисоціації і температуру;
г) співвідношення співвідношення кислота: сіль і тиск розчину.
1.8.5. рН кислотного буферу залежить від:
а) співвідношення компонентів; б) тиску;
в) температури; г) часу.
1.8.6. рН основного буферу залежить від:
а) природи речовин; б) тиску;
в) температури; г) часу.
1.8.7. Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; KHCO3; б) HNO3; NH4NO3;
в) H2CO3; NH4Cl; г) NH4OH; NaH2PO4.
1.8.8.Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; NH4Cl; б) HNO3; NH4NO3;
в) Na2HPO4; H3PO4; г)CH3COOH; CH3COONa.
1.8.9. Кислотним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.10. Основним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1774; Нарушение авторских прав?; Мы поможем в написании вашей работы!