
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РОЗЧИНИ 3 страница
|
|
|
|
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.11. Ацетатна буферна система представлена рівнянням:
а) СН3СООН + СН3СООNa
б) CH3COOH + NaSO4
в) CH3COOH + NaOH г) HCl + CH3COONa
1.8.12. Гідрокарбонатна буферна система представлена рівнянням:
а) H2CO3 + NaCl; б) H2CO3 + Na2CO3;
в) H2CO3 + NaHCO3; г) HCl + NaOH.
1.8.13. Ацетатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 3,7 – 5,6; б) 6,2 – 8,2;
в) 1,3 – 3,4; г) 5,8 – 6,9.
1.8.14. Амонійний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 8,4 – 10,3; б) 5,4 – 6,8;
в) 6,8 – 8,3; г) 4,1 – 5,6.
1.8.15. Фосфатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 5,9 – 8,0; б) 4,8 – 7,2;
в) 8,1 – 9,5; г) 3,2 – 5,8.
1.8.16. Яка із фосфатних буферних систем, що складається із 0,02 молярних розчинів Na2HPO4 i NaH2PO4 , поданих нище, має значення рН=6,81:
а) 40 мл Na2HPO4 та 40 мл NaH2PO4;
б) 10 мл Na2HPO4 та 20 мл NaH2PO4;
в) 20 мл Na2HPO4 та 30 мл NaH2PO4;
г) 25 мл Na2HPO4 та 40 мл NaH2PO4.
1.8.17. Ацетатна буферна система, яка відповідає значенню рН=4,65 складається з 0,01 молярних розчинів СН3СООН і СН3СООNa, які подані у об’ємах:
а) 20 мл СН3СООН та 20 мл СН3СООNa; б) 10 мл СН3СООН та 25 мл СН3СООNa;
в) 30 мл СН3СООН та 15 мл СН3СООNa; г) 20 мл СН3СООН та 10 мл СН3СООNa.
1.8.19 При якому співвідношенні кислота: сіль рН кислотної буферної системи найбільший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.20. При якому співвідношенні кислота: сіль рН кислотної буферної системи найменший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.21. При якому співвідношенні кислота: сіль рН аміачної буферної системи буде найбільша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.22. При якому співвідношенні кислота: сіль рН аміачної буферної системи буде найменша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.23. Наведіть приклади буферних розчинів утворених слабкою основою і її сіллю.
1.8.24. Наведіть приклади буферних розчинів, що містять солі багато основних слабких кислот.
1.8.25. Наведіть приклади буферних розчинів утворених солями багато основних слабких кислот.
1.8.26. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
1.8.27. Механізм дії буферних систем направлений на:
а) відновлення кислих і лужних продуктів;
б) окиснення кислих і лужних речовин;
в) нейтралізацію кислих і лужних продуктів;
г) гідроліз кислих і лужних продуктів.
1.8.28. Механізм дії на ацетатну буферну систему кислотою представлений в рівнянні:
а) СН3СОО- + Н3О+ ↔ СН3СООН + Н2О;
б) NН3∙H2O + H3O+ ↔ NH4+ + 2H2O;
в) H3O+ + HCO3- ↔ H2CO3 + H2O;
г) H3O+ + OH- ↔ 2H2O.
1.8.29. Механізм дії на амонійну буферну систему лугу представлений рівнянням:
а) OH- + H3O+ ↔ 2H2O;
б) NН3 ∙ H2O + H3O+ ↔ NH4+ + 2H2O;
в) OH- + HCO3- ↔ HCO3- + H2O
г) OH- + NH4+ ↔ NH3 ∙ H2O.
1.8.30. Механізм дії на гідрокарбонатну буферну систему кислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
1.8.31. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) H3O+ + HCO3- ↔ H2CO3 + H2O;
б) НСО-3 + OH- ↔ H2CO3
в) H2CO3 + OH- ↔ HCO-3 + H2O
г) H3O+ + OH- ↔ 2H2O.
1.8.32. Механізм дії на фосфатну буферну систему кислотою представлений:
а) НРО4-2 + Н3О+ ↔ Н2РО4- + Н2О
б) НРО4- + Н3О+ ↔ Н3РО4- + ОН-
в) Н2РО4- + ОН- ↔ НРО4-2 + Н2О+
г) НРО4-2 + Н2О+ ↔ Н2РО4- + ОН-.
1.8.33. Напишіть механізм дії аміачної буферної системи при надходженні кислих і лужних продуктів.
1.8.34. Напишіть механізм дії на гідрокарбонтні буферні розчини кислот і лугу.
1.8.35. Напишіть механізм дії на фосфатний буферний розчин кислоти і лугу
1.8.36. Напишіть механізм дії на ацетатний буферний розчин кислоти і лугу.
1.8.37. Рівняння Гендерсона для підрахунку рН кислотних буферних систем:
а) 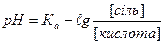
б) 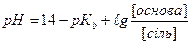
в) 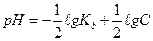
г) 
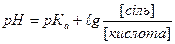
1.8.38. Рівняння Гендерсона для підрахунку рН основних буферних систем:
а) 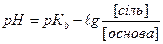
б) 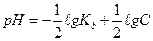
в) 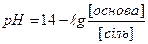
г) 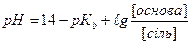
1.8.39. Для розрахунку рН основного буферу необхідно скористатись формулою:
а) 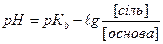
б) 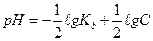
в) 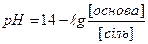
г) 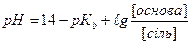
1.8.40. Біохімічні буферні системи організму:
а) гідрокарбонатна, фосфатна, гемоглобінова, білкова;
б) фосфатна, ацетатна, білкова, гідрокарбонатна;
в) гемоглобінові, білкова, фосфатна, амонійна;
г) білкова, ацетатна, амонійна, фосфатна.
Рівняння обчислення рН гідрогенкарбонатного буферу
А) 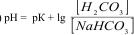 ;
;
Б) 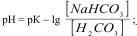
В) 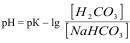
1.8.42. Формула обчислення рН для фосфатного буферу:
а) 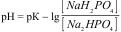 ;
;
Б) 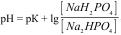 ;
;
В) 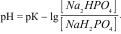
Г) –рК.
1. 9. БУФЕРНА ЄМНІСТЬ.
1.9.1. Буферна ємність це розрахункова величина:
а) визначається молярною масою еквівалента сильної кислоти, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
б) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
в) визначається молярною масою еквівалента сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
г) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН залишився сталим.
1.9.2. На буферну ємність розчинів впливають:
а) константа дисоціації і температура;
б) співвідношення концентрації компонентів і тиск;
в) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину;
г) константа дисоціації і природа буферного розчину.
1.9.3.На буферну ємкість розчинів впливають:
а) константа дисоціації і природа буферного розчину;
б) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину.
в) співвідношення концентрації компонентів і тиск;
г) константа дисоціації і температури.
1.9.4. На скільки одиниць змінюється рН буферного розчину при розрахунку його буферної ємності:
а) 1; б) 2; в) 3; г) 0,5.
1.9.5. Буферну ємність розраховують за об’ємом буферного розчину:
а) 1 дм3; б) 1 см3; в) 1 м3; г) 1 мл.
1.9.6. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти;
в) більше основи; г) менше основи;
д) однакові.
1.9.7. Найбільшу буферну ємність за кислотою має буферний розчин, в якому співвідношення кислоти і солі є:
а) більше кислоти; б) більше солі;
в) однаково; г) менше кислоти.
1.9.8. Розрахунок буферної ємності можна провести за:
а) кислотою і водою; б) кислотою і сіллю;
в) кислотою і основою; г) основою і сіллю.
1.9.9. Величину буферної ємності за кислотою розраховують:
а) 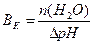 ; б)
; б) 
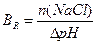 ;
;
в) 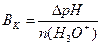 ; г)
; г) 
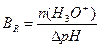 .
.
1.9.10. Величину буферної ємності за основою розраховують:
а)  ; б)
; б) 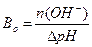 ;
;
в) 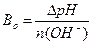 ; г)
; г) 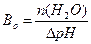 .
.
1.9.11. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти; в) однакові; г) менше основи; д) більше основи.
1.9.12. У плазмі крові найбільшу роль відіграють буферні системи:
а) аміачна; б) гідрокарбонатна;
в) ацетатна; г) гемоглобінна.
1.9.13. У плазмі крові найбільшу роль відіграють буферні системи:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.14. У еритроцитах переважає буферна система:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.15. Які функціональні групи білкових молекул зумовлюють їх буферну дію?
а) –СООН; -NO2; б) –СООН; -NН2;
в) -NН2; -CN; г) -NН2; -NO2.
1.9.16.Механізм дії буферних систем направлений на:
а) нейтралізацію кислих і лужних продуктів;
б) відновлення кислих і лужних продуктів;
в) гідроліз кислих і лужних продуктів;
г) окиснення кислих і лужних речовин.
1.9.17. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти:
а) гідроліз, протоліз, нейтралізація;
б) окислення, гідроліз, протоліз;
в) електролітична дисоціація, протоліз, нейтралізація;
г) електролітична дисоціація, протоліз, гідроліз.
1.9.18. Механізм дії гідрокарбонатної буферної системи при надходженні лужних продуктів представлений рівнянням:
а) Н3О+ + НСО3- ↔ Н2СО3 + Н2О
б) Н3О+ + ОН- ↔ 2 Н2О
в) Н2СО3 + ОН- ↔ НСО3- + Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.19. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) Н3О+ + ОН- ↔ 2Н2О
б) Н2СО3 + ОН- ↔ НСО3- + Н2О
в) Н3О+ + НСО3-↔ 2 Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.20. Кислотно-основна рівновага крові визначається:
а) величиною рН, концентрацією йонів НСО3-, тиском СО2 в крові;
б) величиною рН, концентрацією йонів ОН-, тиском СО2 в крові;
в) величиною рН, температурою, концентрацією йонів ОН-;
г) концентрацією йонів Н3О; ОН-, температурою.
1.9.21. Лужний резерв крові вимірюється:
а) об’ємом СО2; б) об’ємом СО;
в) Об’ємом НО2; г) Об’ємом NО2.
1.9.22. При якому співвідношенні НСО3-:Н2СО3 рН гідрокарбонатного буферу відповідає рН крові:
а) 20:1; б) 15:1; в) 1:1; г) 1:20.
1.9.23. Механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів представлений рівнянням:
а) ННb + OH- ↔ Hb- + H2O
HHbO2 + OH- ↔ HbO2- + H2O;
б) Hb- + H3O+ ↔ ННb + H2O
HbO2- + H3O+ ↔ HHbO2 + H2O;
в) Hb- + H2O ↔ ННb + OH-
HbO2- + H2O ↔ HHbO2 + OH-;
г) Hb- + Н2СО3 ↔ HHbO2 + НСО3-
HbO2- + Н2СО3 ↔ HHbO2 + НСО3-.
1.9.24. Буферна система оксигемоглобін-гемоглобін характеризується рівновагою між йонами:
а) Hb- і ННb б) Hb- і OH-
HbO2- і HHbO2; HbO2- і OH-;
в) Hb- і H3O+ г) Hb- і HHbO2
HbO2- і H3O+; HbO2- і ННb.
1.9.29. Значення рН плазми крові в нормі може знаходитись:
а) 7,35-7,45; б) 6,80-7,0;
в) 7,15-7,35; г) 8,01-8,35.
1.9.30. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) називають:
а) алкалозом; б) анабіозом;
в) ацидозом; г) антагонізмом.
1.9.31. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) називають:
а) ацидозом; б) алкалозом;
в) анабіозом; г) антагонізмом.
1.9.32. Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
1.9.33. Механізм дії білкової буферної системи при надходженні кислих продуктів представлений рівняням:
а) 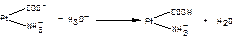 ;
;
б) 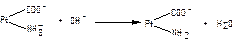 ;
;
в) 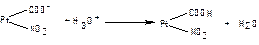 ;
;
г)  ;
;
1.9.34. Механізм дії на фосфатну буферну систему кислотою представлений рівнянням:
а) НРО4-2 + Н2О ↔ Н2РО4- + ОН-;
б) Н2РО4- + ОН- ↔ НРО4-2 + Н2О;
в) НРО4-2 + Н3О ↔ Н3РО4 + ОН-;
г) НРО4-2 + Н3О ↔ Н2РО4- + Н2О.
1.9.35. Напишіть механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів.
1.9.36. Напишіть механізм дії на білкову буферну систему сильної кислоти і лугу.
HHbO2 + OH- ↔ HbO2- + H2O
1.10. КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
1.10.1. Дифузія – це процес:
а) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації;
б) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;
в) переходу речовини із твердого стану в рідкий;
г) переходу речовини із рідкого стану в газоподібний;
д) переходу речовини із одного стану в інший;
1.10.2. Осмос – це процес:
а) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації;
б) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації через напівпроникну мембану;
в) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;
г) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації через напівпроникну мембрану.
Розчинність газів в розчині:
а) тим менша, чим більша концентрація розчинених в розчині солей;
б) тим більша, чим менша концентрація розчинених в розчині солей;
в) не залежить від концентрації розчинених солей;
г) прямо пропорційна концентрації розчинених солей;
д) обернено пропорційна концентрації розчинених солей.
1.10.3. Розчинність газів в рідині:
а) прямо пропорційна тиску газу;
б) обернено пропорційна тиску газу;
в) не залежить від тиску газу;
г) зменшується зі збільшенням тиску;
д) збільшується зі зменшенням тиску.
1.10.4. Кесонна хвороба виникає через:
а) збільшення розчинності газів при зростанні тиску і зменшення розчинності газів в крові при зменшенні тиску;
б) зменшення розчинності газів при зростанні тиску і збільшення розчинності газів в крові при зменшенні тиску;
в) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при збільшенні тиску;
г) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при зменшенні тиску.
1.10.5. «Гірська хвороба» виникає через:
а) збільшення розчинності газів при зростанні тиску і зменшення розчинності газів в крові при зменшенні тиску;
б) зменшення розчинності газів при зростанні тиску і збільшення розчинності газів в крові при зменшенні тиску;
в) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при збільшенні тиску;
г) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при зменшенні тиску.
1.10.6. Осмосом називається процес переходу через напівпроникну мембрану молекул розчинника:
а) із 2 % р-ну NaCl в 10 % р-н NaCl;
б) із 10 % р-ну NaCl в 2 % р-н NaCl;
в) із 5 % р-ну NaCl в 5 % р-н NaCl;
г) із 10 % р-ну NaCl в 10 % р-н NaCl;
д) із 0,9 % р-ну NaCl в 5 % р-н глюкози.
1.10.7. Осмотичний тиск вимірюється в:
а) кПа; б) кДж/моль; в) Па/л;
г) атм/моль; д) Па/моль.
1.10.8. Осмотичний тиск плазми крові рівний:
а) 740-780 кПа; б) 730-750 кПа;
в) 800-850 кПа; г) 700-800 кПа;
д) 720-760 кПа.
1.10.9. Ізотонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.10. Ізотонічним до плазми крові є розчин:
а) 4,5 %-ий глюкози; б) 4,5 %-ий NaCl;
в) 0,45 %-ий глюкози; г) 0,9 %-ий глюкози.
1.10.9. Гіпотонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.9. Гіпертонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.11. Із наведених нижче розчинів гіпертонічним є:
а) 5 % р-н глюкози; б) 0,1 % NaCl;
в) 1,0 % р-н глюкози; г) 10 % NaCl.
1.10.12. Еритроцит вміщений в 0,5 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.13. Еритроцит вміщений в 0,9 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.14. Еритроцит вміщений в 5 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.15. Еритроцит вміщений в 10 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.16. Еритроцит вміщений в 0,9 % розчин глюкози. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.17. Еритроцит вміщений в 5 % розчин глюкози. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.18. Еритроцит помістили в дистильовану воду. При цьому відбуваються процеси:
а) набухання і розтріскування;
б) всихання і зморщування;
в) нічого не відбувається;
г) поглинання води еритроцитом;
д) виділення води еритроцитом.
1.10.19. Еритроцит помістили в 2% розчин CuCl2. При цьому відбуваються процеси:
а) набухання: розтріскування;
б) всихання і зморщування;
в) нічого не відбувається;
г) поглинання води еритроцитом;
д) виділення води еритроцитом.
1.10.20. Порівняйте осмотичний тиск розчинів NaCl і глюкози однаковї молярної концентрації:
а) більший в NaCl; б) менший в NaCl;
в) однакові; г) менший в глюкози;
д) більший в глюкози.
1.10.21.В 1 л розчину, який ізотонічний до плазми крові може бути глюкози:
а) 0,303 моля; б) 0,205 моля;
в) 0,154 моля; г) 0,148 моля;
д) 0,284 моля.
1.10.22. Порівняйте осмотичний тиск розчинів MgCl2 і NaCl однакових молярних концентрацій:
а) більший в MgCl2; б) більший в AgCl;
в) менший в MgCl2; г) однаковий;
д) менший в AgCl.
1.10.23. Порівняйте осмотичний тиск розчинів сахарози і Na3PO3 однакових молярних концентрацій:
а) більший в сахарозі; б) однаковий;
в) більший в Na3PO3; г) менший в сахарозі;
д) менший в Na3PO3.
1.10.24. Порівняйте осмотичний тиск розчинів NaBr і NaCl однакових молярних концентрацій:
а) більший в NaBr; б) однаковий;
в) менший в NaBr; г) більший в NaCl;
д) менший в NaCl.
1.10.25. Температура замерзання розчину в порівнянні із температурою замерзання чистого розчинника:
а) понижується; б) підвищується;
в) не змінюється;
г) понижується, а потім підвищується;
д) підвищується, а потім понижується.
1.10.26. Температура кипіння розчину в порівнянні із температурою кипіння чистого розчинника:
а) понижується; б) підвищується;
в) не змінюється;
г) понижується, а потім підвищується;
д) підвищується, а потім понижується.
1.10.27. Депресією температури замерзання розчину називають:
а) пониження температури замерзання;
б) підвищення температури замерзання;
в) пониження тиску; г) підвищення тиску;
д) зміна температури.
1.10.28. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури замерзання його розчину називається:
а) кріометрією; б) ебуліометрією;
в) кріоскопією; г) осмометрією.
1.10.29. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури кипіння його розчину називається:
а) кріометрією; б) ебуліоскопією;
в) кріоскопією; г) осмометрією.
1.10.30. Кількісно величину осмотичного тиску розчиненого у воді неелектроліту можна визначити законом Вант-Гоффа за формулою:
а) π=CRT б) π=iCRT в) Δp=po x2
г) 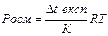 д)
д) 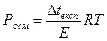
1.10.31. Кількісно величину осмотичного тиску розчиненого у воді електроліту можна визначити законом Вант-Гоффа за формулою:
а) π=CRT б) π=iCRT в) Δp=po x2
г) 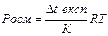 д)
д) 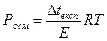
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2452; Нарушение авторских прав?; Мы поможем в написании вашей работы!