
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. 1. Проба на присутність солей кальцію
|
|
|
|
1. Проба на присутність солей кальцію
Налити в пробірку 2-3 мл водопровідної води, додати декілька крапель розчину амоніяку і 1-2 краплі розчину амоній оксалату (NH4)2C2O4. Суміш нагріти до кипіння. За наявністю білої каламуті або осаду, які утворились, роблять висновок про присутність Кальцію. Реакцію можна представити таким рівнянням:
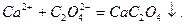
Візуально визначити кількість осаду: мало, багато, дуже багато.
2. Проба на присутність солей магнію
а) йони Mg2+ в присутності йонів Ca2+ виявити не можна. Тому спочатку слід осадити йони Ca2+ у вигляді CaC2O4 додаванням до водопровідної води при нагріванні амоній оксалату до утворення осаду. Осад відфільтрувати і в фільтраті визначити Mg2+.
б) до 2-3 мл фільтрату додати 1-2 мл розчину натрій гідроген- фосфату Na2HPO4 і 2-3 краплі розчину амоніаку, суміш перемішати. При наявності йона Mg2+ утворюється кристалічний осад MgNH4PO4 у вигляді шовковистої каламуті:

3. Проба на присутність хлоридів
До 3-4 мл водопровідної води додати декілька крапель нітратної кислоти, а потім - арґентум нітрату. При наявності йонів Ag+ з’являється білий осад арґентум хлориду або каламуть, якщо їх кількість невелика. Реакцію можна представити рівнянням:

В нітратній кислоті арґентум хлорид не розчиняється, а арґентум карбонат і арґентум сульфіт, які можуть утворитись паралельно, -розчиняються.
4. Проба на присутність сульфатів
До 3-4 мл водопровідної води додати декілька крапель розбавленої хлоридної кислоти, а потім - розчину барій хлориду. Утворення білого кристалічного осаду барій сульфату або каламуті свідчать про наявність у воді сульфат-йонів SO42-. Реакцію можна представити рівнянням:

5. Проба на присутність у воді йонів амонію NH4+
До 3-4 мл водопровідної води додати 3-4 краплі реактиву Несслера (K2[HgI4] + KOH). За наявності йонів амонію утворюється червоно-бурий осад або з’являється жовтогаряче забарвлення (при малих кількостях NH4+).
6. Проба на присутність у воді йонів Fe2+
До 2-3 мл водопровідної води додати 5-6 крапель концентрованої HNO3, а потім - стільки ж розчину амоній роданіду NH4SCN. Червоне або рожеве (за наявності слідів Fe2+) забарвлення, яке зумовлене кольором молекул Fe(CNS)3, свідчить про присутність йонів Fe2+ (концентровану нітратну кислоту додають для окиснення йонів Fe2+ в йони Fe3+). Реакцію можна представити рівнянням:

7. Проба на окиснюваність води
До 1-2 мл водопровідної води додати стільки ж концентрованої H2SO4, потім краплями долити концентрований розчин KMnO4. Якщо рідина тільки від однієї краплі розчину калій манганату забарвиться у рожевий колір, який не зникає протягом 1-2 хвилин, то вода не містить речовини, що окиснюються. Йонне рівняння реакції:
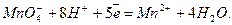
Контрольні завдання
1. Як класифікують хімічні сполуки природних вод за О.Альокіним?
2. Які йони природних вод належать до головних? До складу яких неорганічних сполук вони входять?
3. Зазначте якісні реакції для визначення вмісту в природних водах катіонів амонію.
4. Зазначте якісні реакції для визначення вмісту в природних водах солей магнію.
5. Зазначте якісні реакції для визначення вмісту в природних водах солей кальцію.
6. Зазначте якісні реакції для визначення вмісту в природних водах катіонів Fe2+.
7. Зазначте якісні реакції для визначення вмісту в природних водах хлоридів.
8. Зазначте якісні реакції для визначення вмісту в природних водах сульфатів.
9. Які гази містяться в природних водах? Яке їх походження та сезонна динаміка?
10. Біогенні хімічні елементи природних вод.
11. Органічні речовини природних вод. Їх класифікація.
12. Мікроелементи природних вод, їх класифікація за О.Альокіним.
13. Які речовини зумовлюють окиснюваність води?
14. На чому заснований метод визначення перманганатної окиснюваності води? Відповідь обґрунтувати рівняннями реакцій.
15. Зазначте якісні реакції для визначення вмісту в природних водах катіонів Fe3+.
16. Зазначте якісні реакції для визначення вмісту в природних водах карбонатів.
17. Походження аніонів природних вод та їх склад.
18. Походження катіонів природних вод та їх склад.
19. Які найбільш поширені форми вмісту Нітрогену, Фосфору, Силіцію та Феруму в природних водах.
ЛАБОРАТОРНА РОБОТА № 11
РЕАКЦІЯ ОСАДЖЕННЯ БІЛКІВ
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 561; Нарушение авторских прав?; Мы поможем в написании вашей работы!