
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. У мірну колбу (25 см3) вносять 2 см3 досліджуваного розчину амінокислоти (w=1%), додають 2 краплини тимолфталеїну і по краплях розчин натрій гідроксиду (С =
|
|
|
|
У мірну колбу (25 см3) вносять 2 см3 досліджуваного розчину амінокислоти (w =1%), додають 2 краплини тимолфталеїну і по краплях розчин натрій гідроксиду (С = 0,5 моль/дм3) до блідо-блакитного забарвлення (рН розчину – 10,2). Потім додають у колбу суспензію купрум(ІІ) фосфату. Суспензія спочатку розчиняється, бо Купрум використовується на утворення в лужному середовищі розчинного мідного комплексу амінокислоти синьо-фіолетового кольору. Оскільки вміст амінокислоти в розчині невідомий, то додають надлишок суспензії купрум(ІІ) фосфату. Вміст колби доводять водою до мітки, старанно перемішують перевертанням колби і відфільтровують надлишок купрум(ІІ) фосфату крізь цільний фільтр.
Фільтрат має бути абсолютно прозорим. Цього можна досягнути багаторазовим фільтруванням. З фільтрату піпеткою відбирають дві проби по 10 см3 в конічні колби на 50 см3 для титрування, підкислюють близько 0,4 см3 льодяної ацетатної кислоти до зникнення синього забарвлення мідного комплексу, додають 6-8 см3 розчину КІ з w =10% і йод, що виділився, титрують розчином Na2S2O3 (С (1/2) = 0,01 моль/дм3). Індикатор крохмаль додають до розчину тоді, коли більша частина йоду вже відтитрована і розчин набув солом’яно-жовтого забарвлення.
Проводять контрольне визначення, у якому замість розчину амінокислоти беруть воду. Об’єм розчину Na2S2O3, що витрачався на контрольний розчин, віднімається від його об’єму в досліді.
Хімізм процесу. При взаємодії амінокислоти з суспензією купрум(ІІ) фосфату утворюється забарвлена в синій колір добре розчинна комплексна мідна сіль амінокислоти:

Фосфатна кислота зв’язується боратним буфером, і реакція відбувається до кінця. У фільтраті після відділення надлишку купрум(ІІ) фосфату залишаються лише мідні солі амінокислот (за винятком цистину, мідна сіль якого нерозчинна). Отже, за кількістю Купруму, що ввійшов до складу комплексу, можна визначити вміст амінокислот. При додаванні до розчину мідного комплексу амінокислот концентрованої ацетатної кислоти цей комплекс руйнується і в розчині з’являються йони купруму (Cu2+), вміст яких визначають йодометрією:
2Cu2+ + 4I- → Cu2I2 + I2,
2Na2S2O3 + I2 → 2NaI + Na2S4O6.
За рівнянням реакції 0,5 моль йоду, що виділився, відповідає 1 моль Купруму, який у свою чергу еквівалентний 28 г амінного Нітрогену. Титр робочого розчину Na2S2O3 за визначуваною речовиною, становитиме:
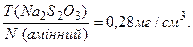
Усі дані зводять у єдину формулу:

де V1 – об’єм розчину Na2S2O3 (С (1/2) = 0,01 моль/дм3), що пішов на титрування, см3; V2 – аліквотний об’єм розчину комплексної мідної солі амінокислоти, см3; V3 – загальний об’єм розчину комплексної мідної солі амінокислоти, см3.
Для розрахунку молярної маси амінокислоти за амінним.
Нітрогеном слід застосувати співвідношення:
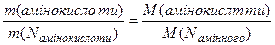 ,
,
 .
.
Масу взятої для дослідження амінокислоти визначають за формулою:
M = V . d . w,
де m – маса амінокислоти, г; V – об’єм розчину амінокислоти, см3; d – густина розчину, г/см3; w – масова частка амінокислоти в розчині.
В умовах даної роботи d можна прийняти за 1. Звідси:
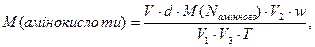 г/моль.
г/моль.
Особливі умови: необхідно знати кількість атомів амінного Нітрогену в молекулі амінокислоти, яка досліджується.
Після проведення дослідження студент подає викладачу оформлений лабораторний журнал і називає значення визначеної відносної молекулярної маси амінокислоти.
Контрольні завдання
1. Амінокислоти кількісно визначають за реакцією з нінгідрином, вимірюючи об’єм СО2, що виділився в результаті реакції. Розрахуйте кількість молей карбону(IV) оксиду, що утворився в результаті реакції нінгідрину з 0,1 г фенілаланіну. Знайдіть об’єм СО2, що утворився в результаті реакції з нінгідрином, 1.10-4 моль амінокислоти (температура – 250С, тиск – 985,5 г Па).
2. Білок містить 0,58% триптофану. Яка мінімальна відносна молекулярна маса цього білка?
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 429; Нарушение авторских прав?; Мы поможем в написании вашей работы!