
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика p-елементів VII групи
|
|
|
|
Вальдорфська Венера». Жіноча статуетка доби пізнього палеоліту. Німеччина.


|

До p -елементів VII групи належать фтор F, хлор СІ, бром Вг, йод І, астат At. Елементи мають загальну назву галогени (буквально «ті, що народжують солі»), оскільки зазначені елементи під час взаємодії з металами утворюють типові солі (KF, NaCl тощо).
Електронна конфігурація валентних підрівнів атомів р -елементів VII групи відповідає формулі ns2np5 та схемі
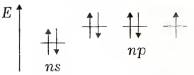
На останньому енергетичному рівні атоми зазначених елементів мають по сім електронів, один з яких є неспареним. Цим пояснюється подібність їхніх властивостей. Наявність одноелектронної орбіталі визначає характерну для всіх елементів валентність 1. Водночас галогени (крім фтору) мають вакантний nd -підрівень, орбіталі якого також можуть брати участь в утворенні хімічних зв’язків і збільшувати валентність атомів елементів до 7.
Молекули галогенів двохатомні, неполярні. Всі галогени є неметалами. В ряду F — Cl — Вг — І — At послаблюються ознаки неметалічності: фтор — найтиповіший елемент-неметал, а астат виявляє деякі властивості елемента-металу.
Деякі характеристики p-елементів VII групи наведено в табл. 6.18.
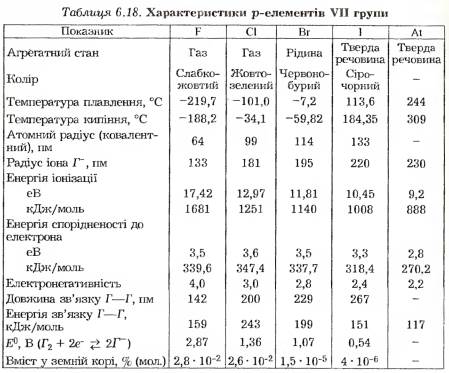
У межах своїх періодів галогени характеризуються малими атомними радіусами, що зумовлює їхні високі електронегатив- ність та спорідненість до електрона, тому для них у складних речовинах найстійкішим є ступінь окиснення — 1.
Серед галогенів фтор має найменший атомний радіус і характеризується значною силою притягання власних валентних електронів до позитивно зарядженого ядра. Це зумовлює його дуже високу енергію іонізації, яка поступається тільки атомам гелію та неону. З цієї причини утворення навіть сольватованого катіона дуже малоймовірне. Це означає, що навіть якби вдалося одержати катіон F-1 (хімічним способом цього домогтися неможливо), то в разі зіткнення з будь-яким атомом, крім зіткнення з атомом Не або Ne, він відніме від нього електрон і перетвориться на атом фтору. У напрямку від фтору до астату збільшується число енергетичних рівнів в атомах цих елементів, внаслідок чого закономірно зростають їхні атомні радіуси. Це зумовлює відповідне зменшення енергії іонізації та електронегативності елементів. У ряду Cl—Вг—І—At з цієї самої причини поступово зменшується енергія спорідненості до електрона. Винятком є фтор, який характеризується меншою енергією спорідненості до електрона порівняно з хлором. Це зумовлено дуже малим розміром атома фтору, внаслідок чого посилюється електростатичне відштовхування електрона, який приєднався, щільною електронною системою атома.
Фтор найбільш електронегативний елемент, тому він не має позитивних ступенів окиснення. В інших галогенів електронегативністьменша, тому поряд зі ступенем окиснення -1 для них можливі позитивні ступені окиснення від +1 до +7, причому вищий ступінь окиснення відповідає загальному числу валентних електронів.
У міру зростання радіусів атомів елементів збільшується довжина хімічного зв’язку в двохатомних молекулах їхніх простих речовин. При цьому зменшується ефективність перекривання їхніх валентних орбіталей і відповідно знижується енергія зв’язку. Винятком є молекула F2, енергія зв’язку F — F у якій менша, ніж у молекулі Cl2. Це пояснюється дуже малим розміром атомів фтору і сильним взаємним електростатичним відштовхуванням електронних систем, які не мають вільних орбіталей.
У двохатомних молекулах простих речовин галогенів реалізується неполярний ковалентний зв’язок, тому їх електричний момент диполя дорівнює нулю. В міру збільшення розмірів молекул зростає здатність їхніх орбіталей до деформації, тобто підвищується поляризованість, що зумовлює істотне посилення міжмолекулярної взаємодії за рахунок дії дисперсійних сил. Цим пояснюють той факт, що в напрямку від фтору до астату закономірно зростають температури плавлення і кипіння цих простих речовин. Чим ближче до позитивно зарядженого атомного ядра розміщений зовнішній електронний шар, тим більш він жорсткий і менш здатний до деформації. Саме з цієї причини молекули F2 і Cl2 значно слабкіше взаємодіють між собою, ніж із молекулами важких галогенів. Відповідно до цього молекули важких галогенів значно легше перевести в рідину, а далі —- в твердий стан, ніж легкі галогени. Тому в ряду F—Cl—Вг—І—At спостерігається перехід від газоподібного стану (F) до твердої речовини (At).
Зміна забарвлення галогенів від світло-зеленого фтору до майже чорного йоду зумовлена особливостями будови електронних оболонок їхніх атомів: пухкість електронної оболонки, тобто рухливість у ній електронів, зростає зі збільшенням атомного радіуса галогену. Отже, якщо легкі галогени відбивають значну частину світлових хвиль, які падають, то важкі галогени більшу частину цих хвиль поглинають (їхня енергія витрачається на збудження слабкозв’язаних електронів). У цьому разі відбивається не все світло, що падає, тому бром і йод мають темне забарвлення.
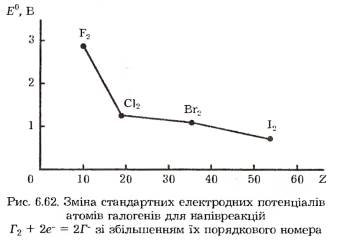
Внаслідок збільшення розмірів атомів від фтору до астату простежується закономірне зниження окиснювальної здатності галогенів і відповідно зростає їх відновна активність. Про це свідчить зменшення в цьому самому напрямку значень стандартних електродних потенціалів елементів (рис. 6.62).
Між хлором і бромом розміщено 18 елементів, десять з яких належать до d -елементів, тому бром, на відміну від фтору і хлору, має 18-електронний передостанній енергетичний рівень. Ефект d -стиснення призводить до певного порушення монотонності у зміні властивостей елементів та їхніх однотипних сполук. З цієї причини фтор і хлор вважають типовими елементами, а решту об’єднують у підгрупу брому.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1957; Нарушение авторских прав?; Мы поможем в написании вашей работы!