
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проста речовина
|
|
|
|
Добування. У промисловості хлор добувають електролізом концентрованих водних розчинів NaCl (значно рідше — інших хлоридів або розплавів).
Хлор виділяється на титанових анодах (рис. 6.66) внаслідок електрохімічного окиснення хлорид-йонів:
| 2Cl- = Cl2 + 2e- | E0 = 1,36 В |
Щоб запобігти побічній анодній реакції окиснення води
| 2Н2О = О2 + 4Н+ + 4е-, | E0 = 1,23 В |
електроліз проводять за високої густини анодного струму (понад 1000 А/м2). Завдяки цьому частка струму, який витрачається на побічний процес утворення кисню, зазвичай не перевищує 0,5-3 %.
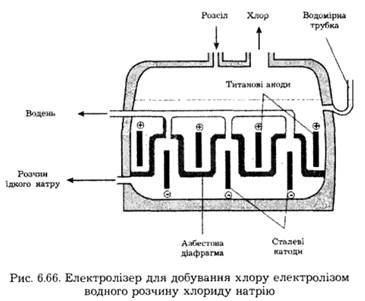
На твердому сталевому катоді відбувається електрохімічна реакція утворення газоподібного водню, а в розчині біля катода (у католіті) накопичується луг NaOH:
| 2Н2О + 2е- = Н2↑+ 2ОН- | E0 = -0,83 В |
Отже, електрохімічний метод одержання хлору дає змогу одночасно отримувати кілька цінних продуктів.
Існують два принципово різні способи добування хлору та лугу електролізом водних розчинів хлориду натрію.
Перший із них — електроліз із твердим катодом полягає в електролізі концентрованого розчину NaCl із залізним катодом та вугільним анодом. У цьому разі на катоді виділяється водень та утворюється луг, а на аноді виділяється хлор (як показано вище). Для запобігання змішуванню продуктів елекролізу катодна та анодна частини електролізера розділені діафрагмою.
Другий спосіб добування хлору і лугу з концентрованих водних розчинів NaCl полягає у використанні електролізу із ртутним катодом. Анодна реакція тут аналогічна попередній, але на відміну від неї на ртутному катоді виділяється металічний натрій, який утворює амальгаму, тобто розчин натрію в рідкій ртуті:
Na+ + 1е- + x Нg = NaНg x.
Побічна катодна реакція виділення водню на ртуті (амальгамі) відбувається з дуже малою швидкістю порівняно з основним у цьому способі катодним процесом відновлення катіонів натрію. Переробляти амальгаму натрію можна кількома способами. Найчастіше її піддають розкладе водою, отримуючи луг та ртуть (останню знову повертають у процес):
NaHg x + Н2О = NaOH + x Нg + 0,5Н2.
За іншим способом можна відігнати ртуть і одержати металічний натрій. Можливість добування хлору без еквівалентної кількості лугу є важливою особливістю способу добування хлору із ртутним катодом, оскільки зростання потреби у хлорі перевищує аналогічну потребу в лузі. Крім того, спосіб із ртутним катодом дає змогу добувати луги високого ступеня чистоти, що важко реалізувати у способі із твердим катодом.
Сухий хлор практично не окиснює залізо, тому його зберігають і транспортують у сталевих балонах під тиском близько 0,608 МПа.
У лабораторних умовах хлор зазвичай добувають окисненням концентрованої соляної кислоти сильними окисниками, наприклад:
4НС1 + МnO2 = С12 + МnС12 + 2Н2O;
16НС1 + 2КМnO4 = 5С12 + 2MnCl2 +2КС1 + 8Н2O;
14НС1 + К2Сr2O7 = ЗС12 + 2СгС13 + 2КС1 + 7 Н2O.
Перша з наведених реакцій цікава тим, що саме за нею в 1774 p. К. В. Шеєле вперше добув хлор. Особливість третьої реакції полягає в тому, що вона відбувається лише під час нагрівання (внаслідок близьких значень стандартних електродних потенціалів напівреакцій) і припиняється за звичайних умов. Це забезпечує її зручність для лабораторного добування хлору.
Фізичні властивості. За звичайних умов хлор – жовто-зелений газ з різким запахом. Токсичний, гранично допустима концентрація хлору в повітрі становить 0,005 мг/дм3, що відповідає 0,00003 % (за об’ємом), концентрація 2 мг/дм3 викликає швидку смерть.
Рідкий хлор спричинює тяжкі опіки, а газоподібний сильно подразнює різні органи організму людини, особливо очі та дихальні шляхи. Він взаємодіє з водою, що міститься в очах, легенях і слизових оболонках органів дихання й утворює з нею соляну і хлорнуватисту кислоти. Симптомами отруєння хлором є печіння в очах та органах дихання, безперервний кашель.
Молекула хлору С12 складається з двох атомів, неполярна. Енергія зв’язку СІ—СІ у ній значно перевищує енергію зв’язку в молекулі F2 (див. табл. 6.18). Це зумовлено низкою причин. З одного боку, як було зазначено вище, в молекулі F2 незв’язуючі електронні пари обох атомів відштовхуються сильніше, ніж у більшій за розміром молекулі С12. З іншого боку, в молекулі хлору зв’язок між атомами значно зміцнюється завдяки додатковому π-зв’язуванню за рахунок неподіленої пари електронів одного атома та вільної 3 d -орбіталі другого. Додаткове π-зв’язування виникає за донорно-акцепторним механізмом, коли кожний атом хлору одночасно є і донором, і акцептором електронної пари (дативний зв’язок). У цьому разі відбувається лише часткове перенесення електронної густини на d -орбіталь атома-партнера за зв’язком, і тому кратність зв’язку менша за 1,5 (вважають, що вона становить 1,12). Згідно з методом валентних зв’язків додаткове π-зв’язування у молекулі С12 можна подати такою схемою (для порівняння поряд наведено також схему молекули F2):
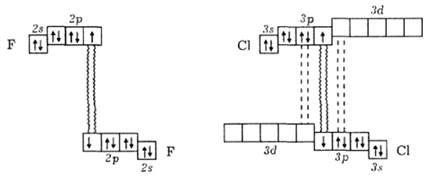
Здатність вільних 3 d -орбіталей одного з атомів хлору до часткового перекривання з р -орбіталями другого атома хлору за л-типом схематично подано на рис. 6.67.
Порівняно з атомом фтору атом хлору має більше число енергетичних рівнів і більший атомний радіус, тому зовнішні електрони слабкіше зв’язані з ядром. Це зумовлює відповідне зростання поляризованості молекули хлору та більшу її здатність до дисперсійної міжмолекулярної взаємодії у конденсованому стані. Як наслідок хлор порівняно з фтором має вищі температури плавлення і кипіння (див. табл. 6.18).
Хлор обмежено розчиняється у воді (за звичайних умов 2 об’єми хлору розчиняються в 1 об’ємі води). Такий слабкий насичений розчин хлору у воді називають хлорною водою.
Розчинність хлору у воді з ростом температури знижується:
| Температура, °С | |||||||||
| Розчинність (об’ємів С12 на 1 об’єм Н2О) | 4,6 | 3,1 | 2,7 | 2,3 | 2,0 | 1,8 | 1,4 | 1,2 | 1,0 |
За температури, нижчої від 10 °С, з насиченого хлором водного розчину випадають зеленкувато-жовті кристали складу С12·6Н20 Відомий також гідрат С12·6Н20. Обидві ці сполуки є клатратами. Значно краще неполярний молекулярний хлор розчиняється в неполярних розчинниках, наприклад за звичайних умов н 1 об’ємі ССІ4 розчиняється близько 50 об’ємів хлору.
Клатрати, або сполуки включення, утворюються вкоріненням молекул одного сорту в порожнини кристалічного каркаса, побудованого з молекул іншого сорту. Решітчасті клатрати існують тільки у кристалічному стані, молекулярні — також і в розчині. Між молекулами у клатраті найчастіше практично немає іншої взаємодії крім вапдер- ваальсівської. Термодинамічна стійкість клатратів зумовлена підхожою геометрією розміщення молекул у порожнинах каркаса, внаслідок чого слабка міжмолекулярна взаємодія забезпечує виграш енергії у 20-50 кДж/моль у разі їх утворення (порівняно з енергією компонентів у вільному стані).
Хімічні властивості. Хлор — активний окисник, він безпосередньо взаємодіє з більшістю неметалів (крім благородних газів, вуглецю, азоту та кисню), а також з переважною більшістю металів, легко окиснює багато складних речовин. Наприклад, натрій миттєво згоряє у середовищі хлору, під час нагрівання окис- пюються інші прості речовини:
2Na + С12 = 2NaCl; Si + 2С12 = SiCl4;
2Р + 5С12 = 2РС15.
За температури понад 500 °С відносно хлору нестійкими є всі метали і сплави. За кімнатної температури сухий хлор не реагує із залізом, тому його зберігають і транспортують у сталевих балонах. Цю саму хімічну властивість хлору використовують для зняття олова з консервних банок: олово взаємодіє із сухим хлором, а залізо — ні. Аналогічну технологію використовують для вилучення алюмінію з металобрухту.
Хлор легко окиснює речовини в розчині. Його високу окисню- вальну здатність можна схарактеризувати значенням стандартного електродного потенціалу:
| 2Cl- = Cl2 + 2e- | E0 = 1,36 В |
Як приклади можна навести такі реакції:
2FeCl2 + С12 = 2FeCl3;
Н2О2 + С12 = 2НС1 + О2↑;
H2SО3 + С12 + Н20 - H2SО4 + 2НС1.
Відновні властивості елементарний хлор виявляє лише під час взаємодії із фтором, і залежно від умов утворює різні фторопохідні, наприклад:
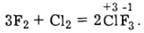
Крім цього, утворюються ClF, ClF5.
У водному розчині хлору відбувається оборотна реакція його самоокиснення-самовідновлення (диспропорціювання) з утворенням двох кислот — соляної НС1 та хлорнуватистої НОСІ:
| С12 + Н2О ⇆ Н+ + С1- + НС1О, | К = 4,1 ·10-4 (20 °С). |
Ця реакція гідролізу хлору в 1897 р. була всебічно вивчена російським ученим О. О. Яковкіним, тому іноді в літературі її називають реакцією Яковкіна.
 Олександр Олександрович Яковкін (I860-1936) — російський хімік, член-кореспондент АН СРСР. Основні дослідження пов’язані з розвитком вчення Д. І. Менделєєва про розчини та проблемами технічнйї хімії. Уперше детально вивчив поведінку хлору у водних розчинах. Синтезував низку ціанідних сполук. Досліджував процес та запропонував спосіб зневоднення мірабіліту (1914). Розробив (1925) спосіб виробництва чистого оксиду алюмінію, який було покладено в основу виробництва і споруджено перший у колишньому СРСР глиноземний завод.
Олександр Олександрович Яковкін (I860-1936) — російський хімік, член-кореспондент АН СРСР. Основні дослідження пов’язані з розвитком вчення Д. І. Менделєєва про розчини та проблемами технічнйї хімії. Уперше детально вивчив поведінку хлору у водних розчинах. Синтезував низку ціанідних сполук. Досліджував процес та запропонував спосіб зневоднення мірабіліту (1914). Розробив (1925) спосіб виробництва чистого оксиду алюмінію, який було покладено в основу виробництва і споруджено перший у колишньому СРСР глиноземний завод.
Кислоти НС1 і НС1О можуть взаємодіяти між собою з утворі-пням хлору і води, тому ця реакція оборотна. Стан рівноваги встановлюється, коли прореагує близько 1/3 розчиненого хлору. З цієї причини концентрація хлорнуватистої кислоти в розчині досягає лише 0,03 моль/л, тобто за кімнатної температури в насиченому водному розчині хлору близько 70 % хлору перебуває у вигляді С12, решта — взаємодіє за наведеною вище реакцією.
У разі додавання лугів за рахунок зв’язування протонів рівновага зміщується вправо, тому розчинення хлору в лужному середовищі практично повністю завершується утворенням продуктів нейтралізації кислот — хлоридів і гіпохлоритів:
С12 + 2КОН = КС1 + КС1О + Н2О
або в іонній формі:
С12 + 2ОН- = С1- + С1О - + Н2О.
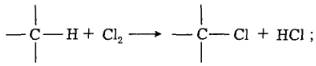
Пряме хлорування органічних речовин широко використовують для добування цінних напівпродуктів та продуктів органічного синтезу. Основні типи реакцій прямого хлорування:
заміщення водню на хлор:
приєднання хлору за місцем кратних зв’язків:
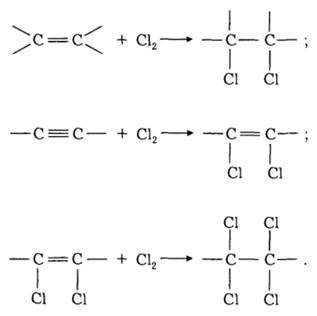
Наприклад, хлорування метану відбувається за радикально-ланцюговим механізмом:
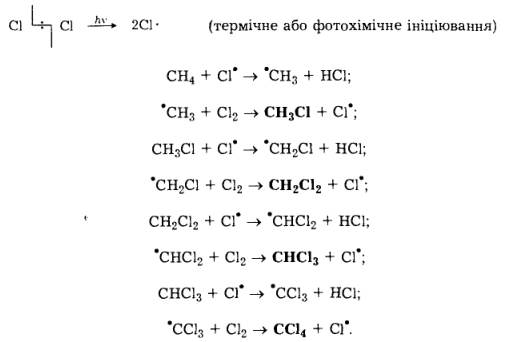
З наведених рівнянь видно, що внаслідок хлорування метану утворюється суміш чотирьох продуктів реакції — хлорметану, дихлорме- тану, трихлорметану (хлороформу) та тетрахлорметану (чотирихло- ристого вуглецю). Всі ці речовини мають важливе технічне значення. Зазвичай чотирихлористий вуглець у промисловості добувають за реакцією
| CS2 + ЗС12 = СС14 + S2Cl2; | CS2 + 2S2Cl2 = СС14 + 6S. |
За наявності каталізаторів досить легко відбуваються реакції хлорування ароматичних вуглеводнів, внаслідок чого утворюються моно-, ди- або поліхлорпохідні.
Етиленові вуглеводні та їхні похідні (ненасичені спирти, ефіри, альдегіди, кетони, кислоти та ін.) легко приєднують хлор. Наприклад, такий поширений розчинник, як 1,2-дихлоретан добувають за схемою
CH2=CH2 + Cl2 = CH2Cl–CH2Cl.
У разі парофазного хлорування етилену за підвищеної температури реакція відбувається за радикальним механізмом з утворенням продукту заміщення водню на хлор:
CH2=CH2 + Cl2 = СН2=СНС1 + HCl.
Цей процес дістав промислове використання. Так добувають хмаристий вініл (хлоретен) —- мономер для виготовлення полівінілхлоридів.
Під час хлорування бензолу та його похідних залежно від умов утворюються різні моно- та поліхлорбензоли, наприклад:

Здебільшого їх використовують як вихідні речовини для синтезу інших органічних сполук, найчастіше барвників.
Прямим хлоруванням каучуку за температури 80°С отримують хлоркаучук, який є дуже цінним термопластом.
Отже, хлор здатний реагувати з більшістю органічних сполук, що широко використовують для добування корисних продуктів. Водночас така висока хімічна активність хлору вводить його в число дуже сильних отрут для тваринних і рослинних організмів.
Класифікація основних типів неорганічних сполук хлору за ' ступенями його окиснення подана наведеною нижче схемою:

|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2339; Нарушение авторских прав?; Мы поможем в написании вашей работы!