
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сполуки
|
|
|
|
Хлороводень. У промисловості чистий хлороводень добувають взаємодією простих речовин:
| '/2Н2 + '/2 Cl2 = HCl(г.), | Δ Н°f,298 = -92,3 кДж/моль |
Ця реакція відбувається за схемою радикальних ланцюгових реакцій і потребує ініціювання. За звичайних умов її швидкість надзвичайно низька, але під час опромінення чи нагрівання, які ініціюють утворення вільних радикалів хлору •СІ, реакція прискорюється до вибуху. Після початкового підпалювання суміш хлору з воднем продовжує горіти спокійним полум’ям з утворенням хлороводню. Максимальна температура полум’я досягає 2200 °С.
Хлороводень добувають також за реакцією хлориду натрію з концентрованою сірчаною кислотою. У разі слабкого нагрівання реакція відбувається за схемою
NaCl(т.) + H2SО4(конц.) = NaHSО4 + HCl↑,
за високої температури гідросульфат натрію реагує з NaCl з утворенням середньої солі:
NaCl + NaHSО4 = Na2SО4 + HCl↑.
Велика кількість так званого «абгазного» хлороводню утворюється як побічний продукт хлорування органічних сполук на різних підприємствах органічного синтезу:
R —H + Cl2 = R —Cl + HCl↑.
Наприклад, фотохімічна радикальна реакція хлорування циклогексану до гексахлорциклогексану (гексахлорану) відбувається за схемою
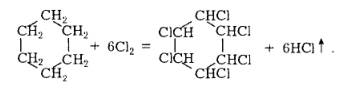
Хлороводень такого походження найчастіше використовують для добування технічної соляної кислоти. Водночас актуальною з промислового та екологічного погляду залишається проблема розробки ефективних методів його спрямованої утилізації.
Взаємодію NaCl з концентрованою H2SО4 використовують як основний спосіб добування хлороводню в лабораторних умовах.
За нормальних умов хлороводень — безбарвний газ з різким запахом (t пл = -114,2 °С, t кип = -85,1 °С), важчий за повітря, легко скраплюється за високого тиску. Він димить внаслідок утворення з водяною парою дрібних крапель туману. Довжина зв’язку Н—СІ у молекулі НСІ дорівнює 127 пм, його енергія становить 431 кДж/моль. Різниця електронегативностей атомів Н і СІ менша, ніж атомів Н і F, тому полярність молекули НСІ (μ = 0,347·10 -29 Кл·м) істотно нижча за полярність молекули HF (μ = 0,64·10 -29 Кл·м). З цієї причини для хлороводню па відміну від фтороводню значно менш властиве утворення водневих зв’язків, і його температура кипіння майже на 100°С нижча за температуру кипіння фтороводню (19,5°С). Порівняно з НF, який необмежено розчиняється у воді, НСІ має велику, але обмежену розчинність (45,15 % за температури 0 °С або близько 450 об’ємів НСІ в 1 об’ємі води за звичайних умов).
Розчинення хлороводню у воді супроводжується виділенням теплоти (теплота розчинення НСІ в 1 кг води становить -26,23 кДж/моль), тому його розчинність закономірно знижується з підвищенням температури:
| Температура, °С | |||||||||
| Розчинність, НС1/ Н2О (за об’ємом) |
У менш полярних порівняно з водою органічних розчинниках розчинність хлороводню НС1 знижується: в діетиловому ефірі - у 3,5 раза, у бензолі — у 50 разів.
Хлороводень утворює з водою азеотропну суміш, яка кипить за нормального тиску і температури 108,6 °С і містить 20,22 % (мас.) НС1.
За температур, нижчих за 0 °С, з водних розчинів НС1 виділено кристалогідрати НС1·Н2О, НС1·2 Н2О і НС1·ЗН2О з температурами плавлення відповідно -25, -18, і -15 °С. Кристалогідрат НС1·Н2О є хлоридом гідроксонію [Н3О]С1. Існування комплексних катіонні Н3О+ у твердих гідратах доведено експериментально.
Водний розчин хлороводню є дуже сильною соляною кислотою:
| НС1 ⇆ Н+ + С1- | К = 107 . |
Її протолітична дисоціація відбувається під дією полярних молекул води, які виступають у цій реакції як основи:
НС1 + Н2О = Н3О+ + С1-.
Для добування чистої соляної кислоти газоподібний хлороводень, що утворюється під час горіння водню у хлорі, пропускають знизу вгору крізь дві абсорбційні (вбирні) колони, які зверху зрошуються водою (рис. 6.68). Заповнення колон насадкою та принцип протитечії забезпечують ефективне вбирання газоподібного НС1 водою з утворенням соляної кислоти.
Концентрована соляна кислота за звичайних умов містить 37 % НС1, її густина становить 1,19 г/см3. Хімічний склад цієї кислоти близький до НС1·3,5Н2О. Приблизний вміст НС1 у водному розчині у відсотках легко знайти, помноживши на 2 число дробових часток його густини. Наприклад, за густини 1,19 г/см3 відсотковий вміст НС1 дорівнюватиме 19·2 = 38 %. І навпаки, знаючи відсотковий вміст НС1 у соляній кислоті тієї чи іншої концентрації, можна приблизно оцінити її густину.
Приготуванням 1,184 н розчину НС1 зручно створювати середовище з pH = 0 (за температури 25 °С).
Як сильна одноосновна кислота, соляна кислота енергійно взаємодіє з багатьма металами та їхніми оксидами з утворенням солей — хлоридів. У реакціях окиснення металів акцептором електронів є іон водню, тому в середовищі НСІ легко розчиняються метали, розміщені в ряду стандартних електродних потенціалів до водню, тобто метали з від’ємними значеннями стандартних електродних потенціалів, наприклад:
Fe + 2НС1 = FeCl2 + Н2↑.
Внаслідок високої агресивності соляної кислоти відносно конструкційних металів, насамперед звичайних сталей, її транспортують і зберігають у скляних бутлях або у футерованих гумою сталевих місткостях.
Більшість солей соляної кислоти добре розчиняється у воді. Важкорозчинними є хлориди AgCl, РЬС12, CuCl, Т1С1, Hg2Cl2, AuCl.
На відміну від HF, соляна кислота окиснюється до вільного хлору такими сильними окисниками, як КМnO4, К2Сr2O7, МnO2 тощо, але не окиснюється концентрованою сірчаною кислотою.
Хлориди. Хлориди металів добувають в основному взаємодією простих речовин, за реакціями обміну та розчиненням металів у соляній кислоті. Хлориди неметалів найчастіше отримують безпосередньою взаємодією простих речовин.
Метали I—IV груп періодичної системи здатні досягати у своїх хлоридах вищого ступеня окиснення, який дорівнює номеру групи. У разі металів V—VIII груп такий стан окиснення, як правило, не досягається. Це пояснюють насамперед недостатньою окиснювальною здатністю хлору та просторовими обмеженнями в разі приєднання великого числа атомів хлору. Атоми в галогенідах s -eлементів, в яких реалізується найбільша різниця їхніх електронегативностей, сполучені іонним зв’язком. Вони утворюють міцні іонні кристали, що мають високі температури плавлення. їх стійкість закономірно зростає в міру збільшення радіуса катіона та послаблення його поляризаційного впливу на аніон хлору, наприклад:
| Хлорид | BaС12 | MgС12 | СаС12 | SrС12 | BаС12 |
| Температура плавлення, °С | |||||
| Δ G0f, 298, кДж/моль | -449,7 | -595,8 | -749,9 | -785,7 | -796,3 |
У молекулах хлоридів елементів побічних підгруп, до катіони на останньому енергетичному рівні атомів не мають електронних конфігурацій благородних газів, які сильно скрапують ядро, взаємна поляризація іонів зростає, а іонність зв’язків за рахунок цього зменшується.
Зі збільшенням ступеня окиснення катіона іонність зв’язку в хлоридах зменшується, а частка ковалентного зв’язку зростає. Наприклад, вищі хлориди свинцю і титану — малюпшіярпі рідини з низькими температурами плавлення (РbС14 — t пл = 8,2°С; ТіС14 — t пл = 21,1°С), а нижчі мають солеподібний характер і високі температури плавлення (РbС12 — t пл = 495°С; ТіС12 — t пл = 1035°С).
На відміну від хлоридів металів хлориди неметалів, які мають меншу різницю електронегативностей атомів, є переважно леткими ковалентними сполуками. Це свідчить про їх молекулярну будову в твердому, рідкому та газоподібному станах, а також про слабку міжмолекулярну взаємодію.
Подібно до оксидів хімічна природа хлоридів закономірно змінюється залежно від характеру зв’язку між атомами: іонні хлориди виявляють основні властивос'і'і, а ковалентні — кислотні. Проміжне становище посідають іонно-ковалентні сполуки, які є амфотерними. Наприклад:
| Хлорид | NaCl | MgCl2 | AlСl3 | SiCl4 | РС15 |
| Температура плавлення, °С | -70 | (субл.) | |||
| Кислотно-основні властивості | Основний | Основний | Амфотерний | Кислотний | Кислотний |
Іонні основні хлориди активних металів як солі сильних кислот та основ практично не гідролізують. Розчинні іонно-ковалентні амфотерні хлориди зазнають часткового та оборотного гідролізу за катіоном, а кислотні ковалентні хлориди здатні повністю гідролізувати з утворенням соляної та відповідної кисневмісної кислоти, наприклад:
РС15 + 4Н2O = Н3РО4 + 5НС1;
SiCl4 + 4Н2O = H4SiО4 + 4НС1,
тому такі хлорпохідні є хлорангідридами відповідних кислот. Наприклад, РС15 — хлорангідрид фосфорної кислоти.
Між хлоридами різних типів можлива кислотно-основна взаємодія за Льюїсом з утворенням аніонних комплексів:
КС1 + AlСl3 = К[А1С14];
ВеС12 + SnCl4 = Be[SnCl6];
2КС1 + ВеС12 = К2[ВеС14].
Хлорнуватиста кислота, гіпохлорити. Хлор з киснем безпосередньо не взаємодіє. Це пояснюють низькою енергією зв’язку С1—О, що виключає можливість застосування високих температур для реалізації цієї реакції, тому кисневмісні сполуки хлору добувають непрямими способами.
Як зазначалося вище, хлор оборотно диспропорціює у водному розчині з утворенням двох кислот -— хлорнуватистої та соляної. З цих двох кислот перша є дуже слабкою (слабкіша за вугільну Н2СO3), а друга — дуже сильною. Цю різку відмінність у силі кислот використовуюсь для їх розділення. Якщо у воді збовтати порошок крейди СаСO3 і після цього пропустити крізь неї С12, то соляна кислота, яка утвориться, реагуватиме з крейдою:
СаСO3 + 2НС1 = СаС12 + СO2↑ + Н2O,
а НС1О накопичуватиметься в розчині.
Хлорнуватиста кислота НС1О не виділена у вільному стані й існує тільки у розбавлених розчинах (максимальна її концентрація за температури 20 °С становить лише 0,03 моль/л). Її молекула має зігнуту будову, атом водню в ній сполучений з атомом кисню:
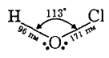
Вона належить до слабких кислот:
| НС1O ⇆ Н+ + OС1- | К = 3,2·10-8 . |
Для хлорнуватистої кислоти в розчинах властиві три різних типи перетворень. Під дією прямого сонячного світла за наявності каталізаторів (наприклад, солей кобальту) або відновників, які здатні легко приєднувати кисень, ця кислота розкладається за реакцією
НС1O = НСІ + О.
За наявності водовідбирних речовин (наприклад, СаС12) із хлорнуватистої кислоти можна одержати її ангідрид — оксид хлору(І):
2HClO = Н2O + С12O↑.
Під час нагрівання хлорнуватиста кислота диепропорціюс за схемою
ЗHClO = 2НС1 + HClO3.
Ангідрид хлорнуватистої кислоти С12O за звичайних умов — жовто-бурий газ із запахом хлору. Його молекула мас зігнуту будову, що визначає її полярність (μ = 0,3·10 -29 Кл·м).
Зручною реакцією добування ангідриду хлорнуватистої кислоти с хлорування при охолодженні свіжоосаджеіюго сухого оксиду ртуті(ІІ):
2HgO + 2С12 = ClHgOHgCl + С12О↑.
Оксид хлору (І) С12O є дуже нестійкою речовиною, за кімнатної температури він поступово розкладається:
4С12O = 2ClO2 + ЗС12,
а під час слабкого нагрівання — розкладається з вибухом на прості речовини:
4С12O = 2С12↑ + O2↑.
Океид хлору(І) С12O добре розчиняється у воді (в 1 об’ємі Н20 — 200 об’ємів С12O) і лише частково реагує з нею з утворенням хлорнуватистої кислоти:
С12O + Н2O = 2HClO.
Інші бінарні сполуки хлору(І) з неметалами також мають кислотний характер:
ClF + Н2O = HClO + HF↑;
Cl3N + 3H2O = ЗHClO + NH3↑.
Солі хлорнуватистої кислоти (гіпохлорити) зазвичай добувають за реакціями диспропорціювання хлору у відповідних холодних лужних розчинах. У разі прожарювання у твердому стані вони диспропорціюють, що характерно для сполук з проміжними ступенями окиснення елементів:
3КClO = 2КСl + КClO3,
а за наявності каталізаторів або відновників гіпохлорити розкладаються з виділенням активного кисню, що зумовлює їх високу окиснювальну здатність:
2КClO = 2КС1 +O2↑.
Хлорнуватиста кислота та її солі є сильними окисниками. Порівняння стандартних електродних потенціалів підтверджує,
що HClO є сильнішим окисником, ніж вільний хлор та гіпохлорити:
| кисле середовище: | 2HClO + 2Н+ + 2e- = СІ2 + 2Н2O, | Е0 = 1,63В; |
| лужне середовище | С1O- + Н2O + 2e- = Cl- + 2OН-, | Е0 = 0,89 В. |
Більша окиснювальна здатність хлорнуватистої кислоти (кисле середовище) зумовлена сильною поляризаційною дією протона на зв’язок О—СІ. Внаслідок цього зв’язок деформується, що робить HClO більш нестабільною сполукою порівняно з гіпохлоритами (лужне середовище). Утворенням хлорнуватистої кислоти під час взаємодії хлору з водою пояснюють вибі- лювальні (окиснювальні) властивості хлору (сухий хлор не вибілює, але за наявності вологи відбувається швидке руйнування барвників хлорнуватистою кислотою, що утворюється).
Вибілювання полягає у знебарвленні матеріалів внаслідок обробки їх окисниками чи відновниками.
Забарвлення органічних матеріалів найчастіше зумовлене наявністю в їхньому складі хромофорів — груп з подвійними ковалентними зв’язками. У разі окиснювального вибілювання ці подвійні зв’язки руйнуються, що спричинює зникнення забарвлення, наприклад:
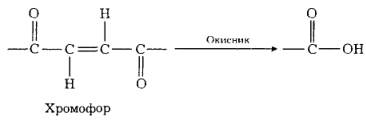
Вибілювання з використанням відновників полягає в перетворенні подвійних зв'язків у хромофорах на прості зв’язки, наприклад:
Рідкі побутові вибілювальні засоби найчастіше містять гіпохлорит натрію, а вибілювальні порошки — гіпохлорит кальцію. Дія обох цих реагентів полягає в окисненні барвників. Для відновного вибілювання використовують сірчистий газ або сульфіт натрію.
Для практичних потреб використовують стійкіші, ніж хлорнуватиста кислота, її солі. Наприклад, під час пропускання хлору крізь холодний розчин КОН утворюється суміш солей хлорнуватистої та соляної кислот:
С12 + 2КОН = КС1 + КClO + Н2O.
Висока окиснювальна активність цього розчину, який називають жавелевою водою і використовують переважно як вибілювальний реагент, зумовлена тим, що гіпохлорит калію легко розкладається вже під дією СO2 повітря з утворенням дуже сильного окисника — хлорнуватистої кислоти HClO:
КClO + СO2 + Н2O = КНСО3 + HClO.
Аналогічний розчин, який містить гіпохлорит натрію, добувають пропусканням хлору крізь розчин NaOH. Обидва розчини можна одержати електролізом водних розчинів КС1 чи NaCl без розділення діафрагмою катодного простору, де накопичується луг, і
анодного, де утворюється хлор. Для запобігання відновлення гіпохлориту на катоді (ClO- + Н2O + 2е- = CF + 2ОН-) до розчину додають 0,1 % Na2Cr2O7, СаС12 або каніфольного мила. Вони утворюють на поверхні катода плівки, які перешкоджають електрохімічному розряджанню на ньому іонів ClO-.
У разі обробки хлором сухого гашеного вапна утворюється так зване білильне, або хлорне, вапно:
Са(ОН)2 + С12 = СаОС12 + Н2O.
Головним його компонентом є хлоридгіпохлорит кальцію СаОС12 — змішана сіль соляної та хлорнуватистої кислот. Це — білий порошок з різким запахом, який має сильні окиснювальні властивості. Якісні торгові сорти хлорного вапна приблизно відповідають складу ЗСа(ОС1)С1·Са(С1)2· n Н2O і містять до 35 % активного (який виділяється під дією НСІ) хлору:
Са(ОС1)С1 + 2НС1 = СаС12 + С12 + Н2O.
У вологому повітрі ця сіль розкладається, вивільняючи хлорнуватисту кислоту (реакція обміну відбувається тому, що вугільна кислота СO2 + Н2O ⇆ Н2СO3 сильніша за хлорнуватисту):
2СаОС12 + СO2 + Н2O = СаСO3 + СаС12 + 2HClO.
Хлорне вапно окиснює навіть соляну кислоту:
2НС1 + СаОС12 = С12 + СаС12 + Н2O.
Реакція окиснення, наприклад йоду, відбувається з утворенням безбарвної йоднуватої кислоти:
І2 + 5HClO + Н2O = 2HIO3 + 5НС1.
Якщо для окиснення використовувати йодиди, то візуально можна спостерігати виникнення на проміжній стадії молекулярного йоду та його поступове перетворення на безбарвний кінцевий продукт.
Хлориста кислота, хлорити. Хлориста кислота HClO2 у вільному стані не виділена, вона відома тільки в розбавлених розчинах, під час зберігання яких дуже швидко розкладається. Ії можна добути за реакціями
ВаO2 + 2ClO2 - Ва(ClO2)2 + O2↑;
Ва(ClO2)2 + H2SO4 = BaSO4↓ + 2HClO2.
Хлориста кислота — це одноосновна кислота середньої сили:
| HClO2 ⇆ Н+ + ClO2- | К = 10-2 . |
Її молекула має зігнуту будову:
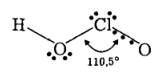
Величина валентного кута (110,5°) свідчить про sp 3-гібридизований стан орбіталей атома хлору. Утворення р-зв’язкіп супроводжується формуванням навколо кожного атома стійкої електронної конфігурації атомів відповідних благородних газів з усіх 20 валентних електронів атомів водню, хлору та кисню. Додаткове я-зв’язуваппя атома хлору з кінцевим атомом кисню відбувається за донорно-акцеїпорним механізмом — зміщенням незв’язуючої пари електронів атома кисню на вільну Згі-орбіталь атома хлору. Отже, в утворенні хімічних зв’язків у молекулі хлористої кислоти беруть участь дві гібридизовані р-орбіталі та одна d -орбіталь атома хлору.
Ангідрид хлористої кислоти невідомий. Розкладається хлориста кислота досить складно:
4HClO2 = 2ClO2 + HClO3 + НСІ + Н2O.
Солі хлористої кислоти (хлорити) значно стійкіші за саму кислоту. Вони утворюються під час пропускання оксиду хлоpy(IV) крізь розчини лугів, наприклад:
2ClO2 + 2КОН = КClO2 + КClO3 + Н2O.
Практично найважливішим хлоритом є хлорит натрію NaClO2. Чисту сіль можна приготувати пропусканням С1O2 крізь розчин пероксиду натрію або лужний розчин пероксиду водню:
2ClO2 + Na2O2 = 2NaClO2 + O2;
2ClO2 + Н2O2 + 2NaOH = 2NaClO2 + O2 + 2Н2O.
Зручним методом добування хлориту натрію є також реакція
2ClO2 + РЬО + 2NaOH = PbO2↓ + 2NaClO2 + Н2O.
Будова аніона ClO2 відповідає трикутнику з валентним кутом 111°, що свідчить про sp3-гібридизаіщо орбіталей атома хлору:
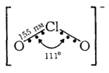
Укорочення довжини зв’язків О—СІ (155 пм) порівняно з довжиною одинарного ковалентного зв’язку СІ—О (170 пм в іоні ClO-) вказує на додаткове л-зв’язування за участю вільної d-орбіталі атома хлору та неподілених пар електронів атомів кисню.
Під час нагрівання тверді хлорити диспропорціюють, а за наявності каталізаторів або відновників розкладаються аналогічно гіпохлоритам:
3NaClO2 —» 2NaClO3 + NaCl;
f °С fCt
NaClO2 ► NaCl + O2T.
За величинами стандартних електродних потенціалів можна зробити висновок, що хлориста кислота HClO2 за своєю окисню- вальною активністю близька до хлорнуватистої, а хлорити істотно поступаються гіпохлоритам:
кисле середовище: HClO2 + 2Н+ + 2е' = HClO + Н2O, Е° = 1,64 В;
лужне середовище: ClO2 + Н2O + 2є = ClO- + 2OН-, Е° = 0,66 В.
З цієї причини хлорити мають сильну окиснювальну здатність тільки в разі підкислення середовища.
Вони є сильними окисниками під час прожарювання, що зумовлено термічним розкладом речовин з утворенням активного кисню.
Оксид хлору(ІУ). У лабораторних умовах оксид хлору(ІУ) ClO2 добувають відновленням хлорату калію щавлевою кислотою під час нагрівання зволоженої суміші вихідних речовин до температури 60°С:
2КClO3 + Н2С2O4 =^= 2ClO2Т + к2со3 + со2Т + н2о.
Оксид хлору(ІУ) можна отримати також у результаті обережного додавання концентрованої сірчаної кислоти до хлориту калію. Реакція відбувається з проміжною стадією виділення не-
стійкої хлорнуватої кислоти. Внаслідок її дегідратації під дією сірчаної кислоти замість невиділеного ангідриду хлорнуватої кислоти виділяється зеленкувато-жовтий газоподібний оксид хлору(ІV) ClOг:
КClOз + H2SO4 = KHSO4 + НСІОу,
ЗHClO3 = 2ClO2 + HClO4 + н2O.
Технічне значення має екзотермічна реакція відновлення хлорату натрію сірчистим газом у середовищі концентрованої (близько 4 моль/л) H2SO4:
2NaClO3 + SO2 + H2SO4 = 2ClO2Т + 2NallSG4.
Зручним методом лабораторного добування оксиду xjiopy(IV) ClO2 є взаємодія хлорату срібла із сухим хлором за темпера тури!)() °С:
2AgClO3 + С12 2ClO2Т + 2AgCI + O2Т.
У разі охолодження газоподібної суміші продуктів реакції до температури, нижчої за 10 °С, оксид ClO2 переходить у рідкий етап і легко відокремлюється від інших газів.
За звичайних умов оксид хлору(ІУ) ClO2 — отруйний зеленкувато-жовтий газ (1ПЛ = ~59,5 °С, п =11 °С) а різким запахом. Він добре розчиняється у воді (в 1 об’ємі — до 20 об’ємів ClO2 за температури 4 °С). Розбавлені розчини (до В г/л) у темряві стійкі, а на світлі повільно розкладаються.
•Під час розчинення у воді відбувається реакція
2ClO2 + Н2O = HClO2 + HClO.-,.
Отже, ClO2 є ангідридом двох кислот.
Оксид хлору(ІУ) ClO2 — ендотермічна сполука (ЛН/>298 = = 105 кДж/моль), тому вже під час слабкого нагрівання або контакту з відновниками розкладається з вибухом на прості речовини. У зв’язку з цим його не транспортують, а виробляють на місці споживання. Він є сильним окисником, що зумовлює його застосування для вибілювання тканин, целюлози та інших матеріалів.
Молекула ClO2 має зігнуту будову з валентним кутом 118°, що свідчить про sp 2-гібридизацію валентних орбіталей атома хлору, і з однаковими довжиною та енергією зв’язків. Трикутна будова молекули визначає її полярність (р = 0,59-10-29 Кл-м). Довжина зв’язку СІ—О становить 148 пм, що значно менше за довжину одинарного ковалентного зв’язку СІ—О у молекулі С12O (170 пм) і наближається до довжини подвійного зв’язку (142 пм).
ч*
Згідно з методом валентних зв’язків розподіл 19 валентних електронів атомів хлору і кисню в разі утворення о-зв’язків можна відобразити такими граничними структурами:
^С1\ " *
Ю: Ю::O: Ю::O::O:
Оскільки довжини та енергії обох зв’язків СІ—О однакові, то реальну молекулу ClO2 слід розглядати як проміжний стан наведених резонансних структур. Для пояснення відносно малої довжини зв’язків та їх високої енергії припустимо, що в молекулі відбувається додаткове л-зв’язування атомів кисню з атомами хлору за рахунок донорно-ак- цепторної взаємодії двохелектронних орбіталей атомів кисню з вільними Зсі-орбіталями атома хлору з утворенням нелокалізованого три- центрового я-зв’язку:
O V-^ O 118°
Наявність у молекулі ClO2 непарного числа електронів визначає її парамагнетизм, а також можливість димеризації молекули. Так, якщо густина пари ClO2 відповідає простій молекулі ClO2, то в розчині в СС14 відбувається часткова димеризація за схемою
2ClO2 -> СІ2О4, К — 1,8 • 10_1 (за температури 25 °С).
З цієї самої причини для ClO2 властиві перетворення з приєднанням або відщепленням електрона. У цьому разі ступінь окиснення атома хлору змінюється відповідно до +3 та +5. Найхарактернішою є елек- троноакцепторна здатність ClO2.
Оксид хлору(ІУ) ClO2 є сильним окисником з високою спорідненістю до електрона (321 кДж/моль). Одночасно обидва шляхи перетворення парамагнітного оксиду ClO2 виявляються під час його диспропорціювання у водних та лужних розчинах (утворюються дві кислоти або дві солі):
2ClO2 + Н2O - HClO2 + HClO3;
2ClO2 + 2NaOH - NaClO2 + NaClO3 + Н2O.
Хлорнувата кислота, хлорати. Оксид хлору(У) С12O5 невідомий, але існють відповідна йому хлорнувата кислота HClO3 та її солі — хлорати. Кислоту HClO3 у вільному стані не виділено, вона існує тільки у розчинах до 40 % (мас.). Розбавлений розчин HClO3 стійкий, концентрована HClO3 — нестійка і досить легко розкладається із сильним вибухом.
Хлорнувату кислоту добувають дією сірчаної кислоти на хлорат барію:
Ва(ClO3)2 + H2SO4 = 2HClO3 + BaSO4l.
У водних розчинах HClO3 — сильна одноосновна кислота:
К = 1.
У водному розчині вона практично повністю дисоціює. Так, він розчині за температури 18 °С уявний ступінь її дисоціації становить 79 %.
Загальний спосіб добування хлоратів — реакція диспропор- ціювання хлору в гарячих розчинах лугів:
ЗС12 + 6ОН' --Є-» 5СГ + СІО3 + ЗН2O.
За підвищеної температури гіпохлорити, які утворюються внаслідок диспропорціювання хлору в холодних лужних розчинах, розкладаються за реакцією самоокиснення-самовідновлення з утворенням хлоратів, наприклад:
+ 5
-1
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 963; Нарушение авторских прав?; Мы поможем в написании вашей работы!