
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сполуки. Фтороводень.Взаємодія між фтором і воднем відбувається з вибухом навіть у темряві і за низьких температур за механізмом радикальних процесів
|
|
|
|
Фтороводень. Взаємодія між фтором і воднем відбувається з вибухом навіть у темряві і за низьких температур за механізмом радикальних процесів. Безбарвне полум’я, яке виникає під час взаємодії вихідних речовин, може досягати температури 4500 °С:
| '/2Н2 + '/2F2 = KF, | Δ Н°f,298 = -273,3 кДж/моль |
тому ця реакція не має практичного застосування для добуваная фтороводню, хоча принципово її можна використовувати для створення реактивної тяги.
Зазвичай фтороводень отримують взаємодією фториду кальцію (флюориту) з концентрованою сірчаною кислотою під час нагрівання:
СаF2 + Н2SО4 = СаSO4 + 2НF.
Для лабораторного добування чистого фтороводню HF та фторидів металів зручно використовувати процес термічного розкладу гідрофторидїв:
KHF2 = KF + HF
Фтороводень — безбарвна речовина (t кип=19,52 °С, t кип = 83,36 °С). За температури, що перевищує температуру кипіння, HF є безбарвним, дуже отруйним газом. Небезпека роботи з фтороводнем посилюється тим, що він має порівняно слабкий запах. Потрапляння рідкого HF на шкіру спричиняє найтяжче ураження, оскільки він легко розчиняє білки і глибоко проникає в тканини. ГІри цьому виникають дуже болісні й тяжкі опіки, що довго гояться (особливо під нігтями). Хімічний зв’язок у молекулі HF має відносно малу довжину (92 пм) і високу енергію (565 кДж/моль), тому фтороводень є дуже стійкою сполукою, ііого термічна дисоціація на атоми стає помітною лише за температури 3500 °С.
Молекула HF полярна, що визначається її великим дипольним моментом (μ= 0,64·10-29 Кл·м), який перевищує дипольні моменти води (μ= 0,61·10-29 Кл·м) та аміаку (μ=0,494·10-29 Кл·м). Якщо припустити, що полярність молекули HF визначається полярністю її зв’язку, то розрахунки ефективних зарядів атомів дають значення δH = +0,43, δF = -0,43. Великі ефективні заряди вказують на високу частку іонності зв’язку, що зумовлено великими значеннями електронегативності фтору та різниці між електронегативностями атомів фтору і водню. Іонно-ковалентний резонанс сприяє зростанню загальної енергії зв’язку.
Фтороводень характеризується здатністю до асоціації завдяки утворенню водневих зв’язків. У газовій фазі за високих температур молекула фтороводню мономерна, за нижчих — утворює асоціати різного складу (HF)n. У цьому разі фтороводень існує у вигляді нескінченних зигзагоподібних ланцюгів:

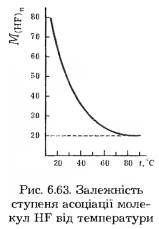 Аналогічні зигзагоподібні ланцюги з молекул фтороводню існують також у твердому його стані (валентний кут 120°, довжина зв’язку F—Н становить 100 пм, зв’язку F···Н — 155 пм) Енергія водневих зв’язків між молекулами HF дорівнює близько 42 кДж/моль, тобто вони міцніші, ніж водневий зв’язок між молекулами Н2O. Цим і зумовлене те, що навіть у газоподібному стані фтороводень складається із суміші полімерів (HF)2, (HF)3, (HF)4, (HF)5, (HF)6. За температури кипіння молекули фтороводню мають середній склад (HF)4. В міру подальшого підвищення температури пари асоціативні агрегати поступово руйнуються і їхня середня молярна маса зменшується. За температури понад 90 °С молярна маса фтороводню досягає стійкого значення 20 г/моль, що свідчить про мономерний склад речовини (M HF=20г/моль). Залежність ступеня асоціації молекул HF від температури показана на рис. 6.63.
Аналогічні зигзагоподібні ланцюги з молекул фтороводню існують також у твердому його стані (валентний кут 120°, довжина зв’язку F—Н становить 100 пм, зв’язку F···Н — 155 пм) Енергія водневих зв’язків між молекулами HF дорівнює близько 42 кДж/моль, тобто вони міцніші, ніж водневий зв’язок між молекулами Н2O. Цим і зумовлене те, що навіть у газоподібному стані фтороводень складається із суміші полімерів (HF)2, (HF)3, (HF)4, (HF)5, (HF)6. За температури кипіння молекули фтороводню мають середній склад (HF)4. В міру подальшого підвищення температури пари асоціативні агрегати поступово руйнуються і їхня середня молярна маса зменшується. За температури понад 90 °С молярна маса фтороводню досягає стійкого значення 20 г/моль, що свідчить про мономерний склад речовини (M HF=20г/моль). Залежність ступеня асоціації молекул HF від температури показана на рис. 6.63.
Рідкий HF є безбарвною рухливою і лег- кокиплячою рідиною. Він має різкий запах, димить на повітрі (внаслідок утворення з парою води дрібних крапель розчину), сильно роз’їдає стінки дихальних шляхів.
Чистий фтороводень за температури 0 °С має дуже низьку електропровідність 1,6·10-4 (Ом·м)-1. У рідкому HF реалізується рівновага самоіонізації, яка сильно зміщена вліво:
| 2HF ⇆ H2F+ + F- | К = 2,07 ·10-4 |
| F- + HF ⇆ HF2- | (H2F3-, H3F4- т. д.). |
Рідкий фтороводень має велику діелектричну проникність (εHF = 83,6 за температури 0°С). Це сильний іонізуючий розчинник, який добре розчиняє неорганічні та органічні сполуки, причому розчини останніх часто мають високу електропровідність. У ньому розчиняються фториди, сульфати та нітрати s -елементів І групи, дещо меншою мірою - аналогічні сполуки s -елементів II групи. Електропровідність розчинів у рідкому фтороводні виникає насамперед внаслідок протонування розчиненої речовини: розчинені речовини, відбираючи від молекул HF протони, збільшують у середовищі концентрацію негативно заряджених іонів HF2, тобто поводяться як основи, наггриклад:
KNО3 + 2HF ⇆ К+ + HNO3 + HF2-.
Навіть індиферентний у воді етанол у рідкому фтороводні виявляється такою самою сильною основою, як гідроксид калію у воді:
С2Н5ОН + 2HF ⇆ С2Н5ОН- + HF2-.
Хімічна активність фтороводню значною мірою залежить від відсутності чи наявності води. Сухий HF не діє на більшість металів, не реагує він і з оксидами металів. Проте, якщо реакція фтороводню з оксидом МеО розпочнеться хоча б якоюсь мірою, то далі вона піде із самоприскоренням, оскільки внаслідок перебігу реакції
МеО + 2HF = MeF2 + H20
кількість води збільшується. Таке явище прискорення реакцій за рахунок каталітичного впливу її продуктів називають автокаталізом.
Фтороводень необмежено розчиняється у воді, при цьому виділяється значна кількість теплоти (58,5 кДж/моль). Для нього характерне утворення азеотропної суміші, яка містить 38,3 % HF і кипить за температури 112 °С.
На відміну від інших дуже сильних галогеноводневих кислот (НСІ, НВг, НІ) водний розчин фтороводню, який називають фтороводневою, або плавиковою, кислотою, є кислотою середньої сили. Незважаючи на значну частку іонності зв’язку в молекулах HF, вони не забезпечують того рівня дисоціації, якого молена було б очікувати. Аномальну поведінку плавикової кислоти пояснюють великою міцністю зв’язків Н—F та здатністю полярних молекул HF до асоціації за рахунок утворення водневих зв’язків. Система водневих зв’язків закріплює стан атомів водню і тим самим утруднює дисоціацію HF у воді. Отже, дисоціація фтороводню на іони потребує значної додаткової енергії, яка необхідна для розриву водневих зв’язків. Іони F-, які утворюються у первинному акті дисоціації, сполучаються водневими зв’язками з недисоційованими молекулами HF та утворюють складніші частинки. Рівновагу процесів дисоціації фтороводню у водних розчинах можна подати такими схемами:
| HF + Н2О ⇆ Н3О+ + F-, | К 1 = 7,2·10-4; |
| HF + F- ⇆ HF2-, | К 2 = 5,1; |
| HF + HF2- ⇆ H2F3-і т. д. |
Внаслідок дисоціації у водних розчинах HF утворюються стійкі гідрофторид-іони HF2-. Порівняння констант рівноваги показує, що в не дуже розбавлених розчинах плавикової кислоти аніонів HF2 міститься значно більше, ніж F-:
| С, моль/л | [HF] | [Н+] | [HF2-] | [HF2-] |
| 0,100 | 0,084 (84 %) | 0,007 (7% ) | 0,006 (6 %) | 0,003 (3%) |
| 1,00 | 0,880 (88 %) | 0,060 (6 %) | 0,010 (1 %) | 0,050 (5%) |
Значна міцність водневих зв’язків зумовлює той факт, що під час нейтралізації розчинів плавикової кислоти утворюються гідрофториди, які добре кристалізуються з розчинів і плавляться без розкладу, наприклад KHF2 (t пл = 239 °С), KH2F3 (t пл = 62 °С), KH3F4 (t пл = 66 °С), KH4F5 (t пл = 72 °С):
2HF + КОН = KHF2 + Н2О.
Аніон HF2- у кристалах солі KHF2 має лінійну структуру з однаковими відстанями (113 пм) між центральним атомом водню та двома кінцевими атомами фтору — в ньому існує так званий симетричний водневий зв’язок. Однаковою є також енергія зв’язків водню з кожним атомом фтору, яка дорівнює 113 кДж/моль наближається до енергії ковалентних зв’язків. Отже, в іоні HF2- існують два рівноцінних частково водневих і частково ковалентних зв’язки. На відміну від лінійного іона HF2-складнішими є гідрофторид-іони, наприклад H2F3-. Вони мають зигзагоподібну будову, яка утворюється за участю водневих зв’язків.
За подальшого додавання до розчину лугу відбувається поступова нейтралізація гідрофторидів з утворенням фторидів:
KHF2 + КОН = 2KF + Н2О.
У здатності плавикової кислоти утворювати стійкі кислі солі полягає її принципова відмінність від інших галогеноводневих кислот, які взагалі не утворюють кислих солей. Під час прожарювання тверді гідрофториди розкладаються, тому, як було залишено вище, їх можна використовувати для лабораторного до- пупання чистого фтороводню:
KH n F n+1 = KH n F n-1 + HF↑.
Характерною особливісю плавикової кислоти с її здатність взаємодіяти з оксидом силіцію(ІУ):
SiО2(т.) + 4HF(p.) = SiF4(г.) + 2Н2О(р.);
SiF4 + 2HF = H2[SiF6],
Перебігом цих реакцій пояснюється руйнівна дія HF та його розчинів на кварц і скло, тому плавикову кислоту збі-рігають не в скляному посуді, а в місткостях, виготовлених зі свинцю, фтопласту, каучуку або поліетилену. Водночас цю властивість плавикової кислоти використовують для травлення скла (виготовлення матового скла, а також нанесення па нього різних малюнків).
Фториди. Фториди добувають дією розчину HF на оксиди, гідроксиди, карбонати, активні метали, а також за реакціями між простими речовинами.
Дуже велика електронегативність фтору та малі іонний радіус і гюляризованість його аніона зумовлюють високий ступінь йонностізв’язків фтору. Цим пояснюють той факт, що фториди металів є найбільш тугоплавкими і термічно стабільними порівняно з іншими галогенідами. Для прикладу нижче наведено значення енергій Гіббса утворення низки аналогічних галогенідів кальцію та їх температури плавлення і кипіння:
| Галогенід кальцію | CaF2 | СаС12 | СаВг2 | СаІ2 |
| Δ G0f, 298, кДж/моль | -1168,5 | -749,4 | -666,6 | -533,1 |
| Температура плавлення, °С | ||||
| Температура кипіння, °С | -2530 | -I960 | 81В |
Дуже висока міцність кристалічних ґраток зумовлює малу розчинність фторидів у воді. Так, за температури 18 °С у 100г води розчиняється 0,0015г CaF 2, тоді як солі кальцію з іншими галогенами добре розчинні.
Розчинними є лише фториди лужних металів (за винятком LiF), а також фториди срібла, алюмінію, олова і ртуті.
Величини радіусів іона фтору F- (136 пм) та іона О2-(140 пм) близькі, тому численні фториди та оксиди з іонною будовою мають подібні склад і кристалічну структуру.
Більшість фторидів металів з низькими ступенями окиснення металу добувають із плавикової кислоти за реакціями обміну. Фториди металів з високими ступенями окиснення та неметалів найчастіше отримують фторуванням простих речовин або нижчих фторидів.
Подібно до оксидів фториди поділяють на основні, кислотні та амфотерні.
Фториди металів з переважно іонним зв’язком у реакціях поводяться як основні сполуки. Фториди неметалів, а також металів з високими ступенями окиснення мають переважно ковалентний зв’язок і за хімічною природою є кислотними. На відміну від дуже твердих і тугоплавких іонних фторидів вони за звичайних умов є газами, рідинами або легкоплавкими твердими речовинами. Це зумовлено тим, що вони утворюють переважно молекулярні кристалічні ґратки, в яких між ковалентними молекулами діють лише слабкі сили міжмолекулярної взаємодії Ван-дер-Ваальса, наприклад:
| Фторид | SiF4 | ClF5 | SF6 | TaF5 | MoF6 | ReF6 |
| Температура плавлення, °С | -86,8 | -103 | -51 | 17,6 | 18,5 | |
| Температура кипіння, °С | -95(субл.) | -14 | -64(субл.) | 229,2 | 33,88 | 33,7 |
Проміжне положення між іонними та ковалентними фторидами займають фториди з високим ступенем полярності зв’язку, які можна назвати іонно-ковалентними сполуками. За хімічною природою вони амфотерні.
Поступовий перехід від іонних основних фторидів до іонно- ковалентних амфотерних і далі — до ковалентних кислотних фторидів на прикладі елементів III періоду можна подати такою схемою:
| NaF MgF2 | AIF3 | SiF4 PF5 SF6 |
| Основні | Амфотерний | Кислотні |
Основні та кислотні фториди під час взаємодії між собою або з амфотерними фторидами утворюють аніонні комплексні фториди, наприклад:
2NaF + SiF4 =Na2[SiF6];
3KF + A1F3 = K3[A1F6];
2A1F3 + 3SiF4 = Al2[SiF6]3.
Отже, в міру послаблення металічних властивостей елементів та іонного характеру їх зв’язку з фтором закономірно зменшується основна і посилюється кислотна функція фторидів. Експериментальні дані свідчать про те, що в разі зростання кислотної функції фторидів зменшується значення Δ G0 процесу їх взаємодії з основними фторидами:
| NaF(т.) + '/3 AIF3(т.) = '/3 Na3[A1F6](т.), | Δ G0 298 = -26 кДж; |
| NaF(т.) + '/2 SiF4(т.) = '/3 Na2[SiF6](т.), | Δ G0 298 = -51 кДж. |
 Невеликі розміри фторид-іона зумовлюють утнорсшш комплексів з великими координаційними числами, наприкладкоординаційне число фторидного комплексу алюмінію [A1F6]3- дорівнює 6, а хлоридного комплексу [А1С14]- внаслідок більшого розміру хлорид-іона — тільки 4.
Невеликі розміри фторид-іона зумовлюють утнорсшш комплексів з великими координаційними числами, наприкладкоординаційне число фторидного комплексу алюмінію [A1F6]3- дорівнює 6, а хлоридного комплексу [А1С14]- внаслідок більшого розміру хлорид-іона — тільки 4.
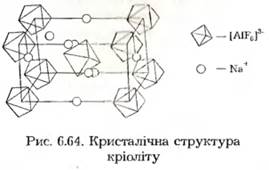
Фторидні комплекси металів надзвичайно численні та різноманітні. Для практики дуже велике значення має кріоліт Na3[A1F6], який використовують у промисловому виробництві алюмінію.
Кріоліт — це кристалічна речовина з t пл = 1009°С. Його кристалічна ґратка побудована з октаедричних іонів [A1F6]3-та іонів Na+ (рис. 6.64).
Оскільки майже всі природні запаси кріоліту вичерпано, то його добувають штучно. Основною сировиною є плавиковий шпат CaF2. Його збагачують до вмісту 95—96 % CaF2, нагрівають у трубчастих печах із сірчаною кислотою до температури 200 °С, отримуючи при цьому гіпс та фтороводень:
CaF2 + H2SO4 = CaSO4 + 2HF↑.
Домішки оксиду силіцію(ІV) Si02 у плавикому шпаті реагують з HF з утворенням газоподібного SiF4:
SiO2 + 4HF = SiF4↑ + 2Н2O.
До очищеної плавикової кислоти додають гідроксид алюмінію:
6HF + А1(ОН)3 = H3[A1F6] + ЗН20.
Після цього H3[A1F6] нейтралізують содою й отримують штучний кріоліт:
2H3[A1F6] + 3Na2CO3 = 2Na3[AlF6]↓ + 3H2O + 3CO2↑.
Осад кріоліту після фільтрування й висушування за температури 150 °С використовують для приготування електроліту для одержання алюмінію.
Основні розчинні фториди як солі кислоти середньої сили зазнають часткового оборотного гідролізу за аніоном. Так, на відміну від інших галогенідів лужних металів, наприклад NaCl, фториди натрію і калію утворюють лужні розчини:
F-+ Н2O = HF + ОН-.
Кислотні фториди гідролізують практично повністю, зумовлюючи кислу реакцію середовища:
| BF3 + ЗН20 = Н3ВО3 + 3HF; | HF + BF3 ⇆ H[BF4]; |
| SiF4 + 3H20 = H2Si03 + 4HF; | 2HF + SiF4 ⇆ H2[SiF6]. |
Сполуки з киснем. В інтервалі температур 100—1000 К фтор з киснем безпосередньо не реагує. На відміну від інших галогенів він також не утворює кисневмісних кислот.
Більшість відомих сполук фтору з киснем — це малостійкі речовини, які існують лише за низьких температур. Оскільки фтор більш електронегативний, ніж кисень, останній у цих сполуках має позитивний заряд, і саме тому їх правильно називати фторидами кисню. Фториди кисню — цб єдині ендотермічні сполуки фтору, наприклад:
| Фторид кисню | OF2 | O2F2 | O3F2 |
| Δ Н°298, кДж/моль | 16,7 | 21,2 | 26,1 |
З усіх фторидів кисню за кімнатної температури існує лише OF2, який утворюється за звичайних умов під дією фтору на 2 '%-й розчин лугу:
2NaOH + 2F2 = OF2 + 2NaF + H2O.
Фторид кисню OF2 — токсичний газ світло-жовтош кольору з характерним запахом фтору (t кип = -145 °С, t пл = -224 °С).
Атоми у OF2 сполучені між собою рівноцінними ковалентними,ш'и:нсами, тому молекула має структуру рівнобедреного трикутника з валентним кутом 103° і довжиною зв’язку 142 пм, по- мириа. Середня енергія зв’язку О—F становить 188,3 кДж/моль.
Фторид OF2 стійкий до температури 200 °С, за вищих температур розкладається на O2 і F2. Він погано розчиняється у воді (7:100 за об’ємом за температури 0 °С), за кімнатної температури дуже повільно реагує з водою і досить швидко — з лужними розчинами з виділенням кисню:
OF2 + Н2O = 2HF + O2↑;
OF2 + 2NaOH = 2NaF + Н2O + O2↑.
Фторид кисню OF2 — дуже сильний окисник (за рахунок позитивно поляризованого кисню), його взаємодія з СО, Н2, галогенідами, вуглеводнями, вуглецем тощо відбувається дуже бурхливо, наприклад:
2Н2(г.) + OF2(г.) = 2HF(p.) + Н2О(р.);
4NH3(г.) + 30F2(г.) = 2N2(г.) + 6HF(p.) + 3Н2О (p.).
Відомі також інші фториди кисню загальної формули OnF2 (n = 2–6), наприклад O2F2, O3F2, які утворюються під чаг припускання електричного розряду високої напруги крізь суміш кисню і фтору за зниженого тиску і низької температури. Ці фториди кисню можуть існувати лише за дуже низьких температур і повністю розкладаються на прості речовини вже за температур, набагато нижчих за звичайну. Так, період напіврозкладу жовто-оранжевих кристалів O2F2 за температури -50 °С становить усього 3 год.
Наприклад, для добування O2F2(t пл = -163,5 °С, за вищої температури — червона рідина, за температури понад 78 °С розкладається на O2 і F2) суміш кисню і фтору в співвідношенні 1: 1 пропускають за низького тиску крізь охолоджувану рідким азотом до -180 °С трубку й одночасно вмикають електричний розряд високої напруги:
O2 + F2 = O2F2.
За іншим способом суміш 02 і OF2 опромінюють ультрафіолетовим світлом:
O2 + 2OF2 = 2O2F2.
У молекулі O2F2 довжина зв’язків між атомами кисню становить 121,7 пм, що практично дорівнює довжині ковалентного зв’язку в молекулі O2 (121 пм). Це дає змогу припустити, що приєднання до молекули O2 двох атомів фтору істотно не змінює її внутрішньої структури, а молекулі O2F2 приписати будову з чотиривалентним киснем:
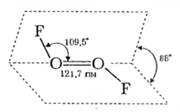
Фторид кисню O2F2 — дуже сильний окисник і фторувальний агент. Його реакції відбуваються бурхливо навіть за дуже низьких температур, наприклад:
SF4 + O2F2 = SF6 + O2; PF3 + O2F2 = PF5 + O2.
Сполуки з вуглецем. Однією з таких сполук є фторований графіт (CF)n — білий порошок, який утворюється внаслідок реакції вуглецю (графіту) з газоподібним фтором під час нагрівання:
nС(т.) + n/2F2(г.) = (CF)n(T.).
Енергія зв’язку С—F у фторованому графіті становить 460-480 кДж/моль, що збігається з енергією ковалентного зв’язку С—F у молекулах звичайних фторвуглеців. Це дає змогу припустити, що у фторованому графіті атоми фтору сполучені з атомами вуглецю міцним ковалентним зв’язком. Як відомо, у графіті атоми вуглецю перебувають у стані sр2 -гібридизації й утворюють плоскі шари з конденсованих шестикутників. Внаслідок приєднання атомів фтору атоми вуглецю переходять у стан sр 3-гібридизації, площинна будова шарів порушується і вони набувають зигзагоподібної форми (рис. 6.65).
Внаслідок малої енергії взаємодії між шарами у (CF)n відстань між ними залежно від сировини та умов синтезу змінюється в межах 568-850 пм, тому фторований графіт широко застосовують як тверде мастило.
Фторований графіт — це хімічно та термічно стійкий гідрофобний неорганічний полімер з діелектричними властивостями.
Сполуки з хлором і вуглецем. Хлорфторвуглеці добувають частковим заміщенням атомів хлору в хлорвуглецях на атоми фтору за участю НF та за наявності каталізаторів Kt, наприклад:
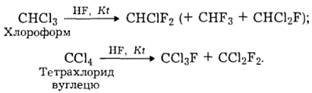
Такі сполуки хімічно стійкі й термостабільні, нешкідливі для живих організмів. Їх використовують як холодоагенти (фреони) у побутовому та промисловому холодильному устаткуванні. Завдяки своїм високим експлуатаційним властивостям вони замінили небезпечні NH3 і SО2 та створили умови для масового використання холодильної техніки.
Водночас значна їх стійкість, яка позитивно характеризує хлорфторвуглеці як фреони, виявилася небажаною з погляду екологічної безпеки. Оскільки хлорфторвуглеці, потрапляючи в атмосферу, не руйнуються, відбуваються їх поступове накопичення та постійна дифузія у стратосферу, де вони розкладаються за вільнорадикальним механізмом під дією сонячної радіації з утворенням атомів' хлору, наприклад:
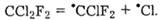
Атоми хлору каталізують процес розкладу озону, який міститься у стратосфері і захищає тваринний і рослинний світ Землі від згубного для всього живого ультрафіолетового випромінювання з довжиною хвилі 280-320 нм:
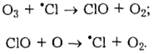
З цієї причини доводиться обмежувати використання хлорфторвуглеців.
Фторовмісні полімери (фторопластм). Вихідною сировиною для добування фторопластів є тетрафторетилен CF2=CF2. Його одержують піролізом CHClF2 за температури 650 °С або розкладом CHClF2 водяноюпарою за наявності каталізатора А12О3, наприклад:
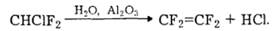
Під час полімеризації тетрафторетилену за наявності каталізаторів за радикальним механізмом утворюється політетра- фторетиленова смола (тефлон):
n CF2=CF2 → (—CF2—CF2—) n.
Такі полімери мають високу термічну стійкість. Вони не змінюють своїх механічних властивостей після тривалого нагрівання за температури 250 °С. Найважливішою особливістю фторопластів є виняткова хімічна стійкість. За цим показником вони перевищують усі відомі нині синтетичні смоли. Вони не змінюються під дією жодних розчинників за температури їх кипіння. Царська горілка за температури 50 °С, олеум за температури 80 °С, концентрована сірчана кислота за температури 300 °С та 50 %-й водний розчин NaOH за температури 100 °С не руйнують ці полімери. Відомі лише два реагенти, які впливають на них: розплавлений металічний натрій за температури 200 °С і газоподібний фтор за температури понад 150 °С.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2295; Нарушение авторских прав?; Мы поможем в написании вашей работы!