
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса. Независимость теплового эффекта реакции от химического пути проведения процесса при постоянном давлении называется законом Гесса
|
|
|
|
Независимость теплового эффекта реакции от химического пути проведения процесса при постоянном давлении называется законом Гесса. Этот закон позволяет рассчитать неизмеренное значение D H° химической реакции, если известны все другие значения D H° на некотором обходном пути осуществления процесса.
Пример 1
Образование оксида углерода (IV) из графита и кислорода можно рассматривать или как непосредственный результат взаимодействия простых веществ:
С(графит) +О2(г)=СО2(г), D H°1
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II):
С(графит) +½О2(г)=СО(г), D H°2
СО(г) +½О2(г)=СО2(г), D H°3.
Если сложить последние два уравнения (тепловой эффект, очевидно, также суммируется), то получим
С(графит) +О2(г)=СО2(г), D H°2 +D H°3
 Согласно закону Гесса тепловые эффекты образования CO2 как непосредственно из простых веществ, так и через промежуточную стадию образования и сгорания СО равны
Согласно закону Гесса тепловые эффекты образования CO2 как непосредственно из простых веществ, так и через промежуточную стадию образования и сгорания СО равны
D H°1= D H°2+ D H°3
Тепловые эффекты образования СО2 и горения СО можно измерить экспериментально (D H°1 = -393,5 кДж/моль, D H°3. = -283,0 кДж/моль) Тепловой же эффект образования СО точно измерить затруднительно, так как при горении углерода в условиях недостатка кислорода образуется смесь CO и СО2. Тем не менее, тепловой эффект второй реакции можно найти исходя из закона Гесса:
D H°2 =D H°1 -D H°3 = -393,5-(-283,0)= -110,5 кДж/моль.
Внимание лицеистов! Я настаиваю на подобной форме записи решения: сначала пишется формула с требуемыми значениями стандартной энтальпии и правильными знаками, затем подставляются численные значения энтальпии со знаком в скобках (если требуется). Только затем производится расчет. Подобная форма записи убережет Вас от типичных ошибок в знаке слагаемого (90% ошибок в задачах по термохимии).
Химическое уравнение существенно отличается от алгебраического по смысловой нагрузке. Так уравнения a+b=c и c=a+b эквивалентны. Если же мы захотим подобным образом «перевернуть» химическое уравнение, мы с большой долей вероятности получим ересь. Водород и кислород охотно реагируют с образованием воды, выделяя при этом значительное количество тепла:
H2(г)+ ½O2(г)=H2O(ж) D H°1.
Вода же, к счастью всех живущих на Земле существ, до сих пор не была замечена в самопроизвольном разложении на водород и кислород
H2O(ж)=H2(г)+ ½О2(г) D H°2 ,
а потому, данное химическое уравнение на первый взгляд не имеет смысла. Я очень надеюсь на то, что на предыдущих уроках химии вы крепко-накрепко усвоили, что следует писать только те уравнения, которые хоть как-то соответствуют реальным процессам, а не просто удовлетворяют условию равенства числа атомов справа и слева. Только если это правило для вас очевидно и незыблемо, я позволю себе его нарушить.
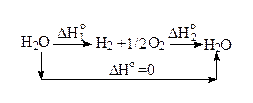 Давайте отвлечемся от вопроса, идет или не идет химическая реакция, и сосредоточимся на вопросе о ее тепловом эффекте. В задачах на нахождение теплового эффекта по закону Гесса мы будем себе позволять писать самые немыслимые (с точки зрения грамотного химика) уравнения реакций, интересуясь, в первую очередь, не возможностью проведения подобного процесса, а его тепловым эффектом.
Давайте отвлечемся от вопроса, идет или не идет химическая реакция, и сосредоточимся на вопросе о ее тепловом эффекте. В задачах на нахождение теплового эффекта по закону Гесса мы будем себе позволять писать самые немыслимые (с точки зрения грамотного химика) уравнения реакций, интересуясь, в первую очередь, не возможностью проведения подобного процесса, а его тепловым эффектом.
Согласно закону Гесса, если воду сначала разложить на водород и кислород, а потом из них снова образовать воду, то тепловой эффект реакции получения воды из воды (он, очевидно, равен нулю) будет равен сумме тепловых эффектов указанных реакций:
0=D H°1 +D H°2
Таким образом, мы можем сделать вывод, что стандартная энтальпия обратной реакции равна по абсолютному значению и противоположна по знаку стандартной энтальпии прямой реакции.
D H°2 = - D H°1
В примере 1 мы наблюдали, что реакции можно складывать, и тепловые эффекты будут складываться. Сейчас мы убедились в том, что реакции можно условно «переворачивать», и стандартная энтальпия реакции поменяет знак. Кроме того, реакции можно домножать на необходимые коэффициенты, при этом тепловой эффект изменится пропорционально этим коэффициентам:
H2(г)+ ½O2(г)=H2O(ж) D H°1 = - 285,8 кДж/моль
2H2(г)+O2(г)=2H2O(ж) D H°3 = - 571,6 кДж/моль
D H°3 =2 DH°1
Действуя с химическими уравнениями так же, как и с алгебраическими (складывая, вычитая, домножая на коэффициенты), мы не разрешим вопрос о возможности прохождения новых результирующих процессов, но мы найдем их тепловые эффекты.
Пример 2
Требуется вычислить стандартную энтальпию образования пероксида водорода в водном растворе при 298 К, используя следующие термохимические уравнения:
(I) SnCl2(р-р*) + 2HCl(р-р) + H2O2(р-р)= SnCl4(р-р) + 2H2O(ж) 
(II) SnCl2(р-р) + HCl(р-р) + HOCl(р-р)= SnCl4(р-р) + H2O(ж) 
(III) 2HI(р-р) + HOCl(р-р) = I2(к) + HCl(р-р) + H2O(ж) 
(IV) ½H2(г) + ½I2(к) (+ ¥ H2O(ж))=HI(р-р) 
(V) H2(г) + ½O2(г) = H2O(ж) 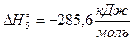
* здесь и далее в разделе «Тепловые эффекты химических реакций» под сокращением р-р подразумевается бесконечно разбавленный водный раствор.
Под стандартной энтальпией образования пероксида водорода в водном растворе подразумевается стандартная энтальпия реакции образования данного вещества из простых веществ:
(VI) H2(г) + O2(г) (+ ¥ H2O(ж)) = H2O2(р-р) 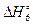
(Напоминаю, что вода, как бы проста ни казалась, простым веществом ни в коей мере не является, поэтому реакция Н2О+½О2=Н2О2 к делу не относится. В скобках вода указывается как среда, требуемая для образования раствора, а не как действующее вещество.)
Используя сложение, вычитание и умножение на коэффициенты, постараемся составить из известных реакций (I)-(V) такую комбинацию, чтобы в итоге получить искомое уравнение (VI). При этом стандартная энтальпия реакции (VI) DH°6 будет равен такой же алгебраической комбинации стандартных энтальпий реакций (I)-(V).
Искомый продукт реакции (H2O2(р-р)) присутствует только в первом уравнении, но не в продуктах, а в реагентах. Поэтому мы возьмем уравнение (I) в «перевернутом» виде, поменяв знак энтальпии на противоположный:
SnCl4(р-р) + 2H2O(ж)=SnCl2(р-р*) + 2HCl(р-р) + H2O2(р-р) 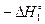
При сравнении полученного результата с искомым уравнением (VI) возникает желание избавиться как минимум от хлоридов олова. Для этого сложим полученное уравнение с уравнением (II), при этом тепловые эффекта также сложатся:
SnCl4(р-р) + 2H2O(ж)=SnCl2(р-р*) + 2HCl(р-р) + H2O2(р-р) 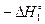
SnCl2(р-р) + HCl(р-р) + HOCl(р-р)= SnCl4(р-р) + H2O(ж) 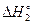
H2O(ж) + HOCl(р-р)= HCl(р-р) + H2O2(р-р) 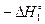 + + 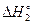
|
В результирующем уравнении «лишними» являются хлорсодержащие кислоты. Чтобы избавиться от них, вычтем из полученного уравнения уравнение (III):
H2O(ж) + HOCl(р-р)= HCl(р-р) + H2O2(р-р) 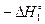 +
+ 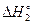
I2(к) + HCl(р-р) + H2O(ж)= 2HI(р-р) + HOCl(р-р) - 
2H2O(ж) + I2(к) = 2HI(р-р) + H2O2(р-р) 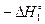 + + 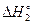 - - 
|
Хочется еще раз обратить внимание на то, что уравнения, полученные алгебраической комбинацией нескольких химических реакций, не несут в себе химического смысла. Действительно, странно было бы ожидать от кристаллического йода взаимодействия с водой. Мы рассматриваем такие уравнения только как промежуточный этап расчета стандартной энтальпии образования некоторой реакции. В данном случае – реакции «получения» пероксида водорода из простых веществ, реакции еще более сомнительной для любого здравомыслящего химика, но полезной для термохимических расчетов.
В результирующем уравнении вместо хлора появился другой «лишний» элемент – йод. Чтобы избавится от йода, вычтем удвоенное уравнение (IV):
2H2O(ж) + I2(к) = 2HI(р-р) + H2O2(р-р) 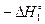 +
+ 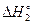 -
- 
2HI(р-р) =H2(г) + I2(к) (+ ¥ H2O(ж)) 
2H2O(ж) = H2(г) + H2O2(р-р) (+ ¥ H2O(ж)) 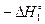 + + 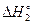 - -  
|
Прибавляя удвоенное уравнение (V), приходим в итоге к следующему уравнению:
2H2O(ж) = H2(г) + H2O2(р-р) (+ ¥ H2O(ж)) 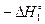 +
+ 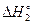 -
- 

2H2(г) + O2(г) = 2H2O(ж) 
H2(г) + O2(г) = H2O2(р-р) (+ ¥ H2O(ж)) 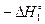 + + 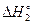 - -   + + 
|
Мы получили искомое уравнение (VI), но с одним отличием: (+ ¥ H2O(ж)) стоит не с той стороны. Здесь уместно задать вопрос о том, что мы подразумеваем под данной записью. Если рассмотреть следующие уравнения реакций:
½H2(г) + ½I2(к) (+ ¥ H2O(ж))=HI(р-р)
½H2(г) + ½I2(г) (+ ¥ H2O(ж))=HI(р-р)
½H2(г) + ½I2(к) =HI(г)
½H2(г) + ½I2(г) =HI(г),
то все они будут иметь различный тепловой эффект, так как состояния веществ, участвующих в реакции различно.
Внимание! В задачах на закон Гесса с двух сторон уравнения можно сокращать одно и то же вещество только в одинаковом состоянии! Если в-во присутствует в разных состояниях, требуется использовать стандартную энтальпию перехода данного вещества из одного состояния в другое (стандартная энтальпия растворения, возгонки, перехода из одной аллотропной модификации в другую и т.д.)
Добавление слагаемого (+ ¥ H2O(ж)), хоть и встречается в ряде учебников, строго говоря, не является совсем правильным, так как не удовлетворяет равенству числа элементов в уравнении справа и слева. Но его все-таки пишут, чтобы подчеркнуть состояние результирующего вещества. А так как запись этого слагаемого является условной, мы можем просто вычеркнуть его из рассмотрения.
Внимание! Не следует сокращать воду в качестве среды (+ ¥ H2O(ж)) с водой в качестве действующего вещества +Н2О. При комбинации уравнений воду-среду можно мысленно вычеркнуть из уравнений, обращая пристальное внимание на состояния веществ (к, г, р-р).
Для самых въедливых лицеистов, желающих подумать о бесконечности, предлагаю найти более строгое объяснение, учитывая, что тепловой эффект двух реакций
2H2(г) + O2(г) = 2H2O(ж)
2H2(г) + O2(г) (+ ¥ H2O(ж)) = 2H2O(р-р)
одинаков.
Мы показали, что в примере 2 реакция (VI) может быть составлена как комбинация реакций -(I)+(II)-(III)-2(IV)+2(V), соответственно, искомая стандартная энтальпия равна
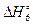 =
= 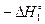 +
+ 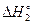 -
- 
 +
+  = -(-371,6)+(-314,0)-(-215,2)-2×(-55,1)+
= -(-371,6)+(-314,0)-(-215,2)-2×(-55,1)+
+2×(-285,6)= -188,2 кДж/моль
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 842; Нарушение авторских прав?; Мы поможем в написании вашей работы!