
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление теплового эффекта реакции при постоянном давлении. Два следствия из закона Гесса
|
|
|
|
Задачи
1. Вычислите стандартную энтальпию перехода графита в алмаз, если при образовании углекислого газа CO2 из графита выделяется 393,5 кДж/моль, а при образовании CO2 из алмаза выделяется 395,4 кДж/моль.
2. Исходя из стандартной энтальпии образования H2O(ж) и стандартной энтальпии реакции
H2O2(ж)=H2O(ж)+½O2(г) D H° 298 = -98,3 кДж/моль,
вычислите стандартную энтальпию образования H2O2(ж).
3. Используя следующие термохимические уравнения,
KClO3(к)=KCl(к)+3/2O2(г) D H º298= -49,4 кДж/моль
KClO4(к)=KCl(к)+2O2(г) D H º298= 33 кДж/моль,
вычислите D H º298 реакции
4KClO3(к)= 3KClO4(к) + KCl(к)
4. Исходя из стандартных энтальпий реакций окисления As2O3 кислородом и озоном
As2O3(к)+O2(г)= As2O5(к) D H° 298 = - 271 кДж/моль;
As2O3(к)+2/3O3(г)= As2O5(к) D H° 298 = - 365 кДж/моль,
вычислите стандартную энтальпию образования озона.
5. На основании приведенных ниже данных вычислить стандартную энтальпию образования ZnSO4(к):
ZnS(к) = Zn(к) + S(ромб) D H°1 = 183,9 кДж/моль
2ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) D H°2 = -927,5 кДж/моль
2SO2(г) + O2(г) = 2SO3(г) D H°3 = -196,0 кДж/моль
ZnSO4(к) = ZnO(к) + SO3(г) D H°4 = 230,3 кДж/моль
6. Вычислить изменение энтальпиив ходе реакции
CH4(г) + Cl2(г) = CH3Cl(г) + HCl(г)
зная изменение энтальпии D H° в ходе следующих реакций:
CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж) D H°1 = -889,5 кДж /моль
CH3Cl(г) + 3/2O2(г) = CO2(г) + H2O(ж) + HCl(г) D H°2 = -685,5 кДж /моль
H2(г) + ½O2(г) = H2O(ж) D H°3 = -285,6 кДж /моль
½H2(г) + ½Cl2(г) = HCl(г) D H°4 = -92,2 кДж /моль
7. Используя приведенные ниже данные
2C(графит) + H2(г) = C2H2(г) D H °1 = +226,8 кДж/моль;
C(графит) + O2(г) = CO2(г) D H°2 = -393,5 кДж /моль;
H2(г) + ½O2(г) = H2O(ж) D H°3 = -285,6 кДж /моль;
CH3CHO(ж) + 2,5O2(г)=2CO2(г)+2H2O(ж) D H°4 = -1167 кДж /моль,
вычислить D H ° для процесса
C2H2(г)+H2O(ж)=CH3CHO(ж)
8. Найти на основании следующих данных стандартные энтальпии образования и сгорания этилена (C2H4(г)).
C2H4(г) + H2(г) = C2H6(г) D H°1 = -136,8 кДж /моль
C2H6 (г)+ 7/2O2(г) =2CO2(г) +3H2O(ж) D H°2 = -1570,9 кДж /моль
C(графит) + O2(г) = CO2(г) D H°3 = -393,1 кДж /моль
H2(г) + ½O2(г) = H2O(ж) D H°4 = -285,6 кДж /моль
9. Определить стандартную энтальпию образования As2O3 на основании следующих термохимических уравнений:
As2O3(к) + 3H2O(ж) (+¥H2O(ж)) = 2H3AsO3(р-р) D H °1= 31,61 кДж/моль
As(серый) + 3/2Cl2(г)=AsCl3(г) D H °2= -298,90 кДж/моль
AsCl3(г)+3H2O(ж)(+¥H2O(ж))=H3AsO3(р-р)+3HCl(р-р)D H °3= -73,60кДж/моль
½H2(г) + ½Cl2(г) = HCl(г) D H °4= -92,37 кДж/моль
HCl(г)(+¥H2O(ж)) =HCl(р-р) D H °5= -72,49 кДж/моль
H2(г) + ½O2(г) = H2O(ж) D H °6= -285,6 кДж/моль
10. Вычислите стандартную энтальпию образования водного раствора азотистой кислоты, воспользовавшись стандартными энтальпиями представленных реакций:
NH4NO2(р-р)=N2(г)+2H2O(ж) D H°1 = -320,0кДж/моль;
NH3(р-р)+HNO2(р-р)= NH4NO2(р-р) D H°2 = -37,7 кДж/моль;
NH3(р-р)=1/2N2(г)+3/2H2(г) D H°3 = +84,9 кДж/моль;
H2(г) + ½O2 (г)= H2O(ж) D H°4 = -285,6кДж/моль.
11. Вычислите стандартную энтальпию сгорания газообразного гидразина N2H4(г) на основании следующих термохимических уравнений:
2NH3(г) + 3N2O(г) = 4N2(г) + 3H2O(ж); D H°1 = -1011,6 кДж/моль
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж); D H°2 = -272,7 кДж/моль
2NH3(г) + ½O2(г) = N2H4(г) + H2O(ж); D H°3 = -98,3 кДж/моль
H2(г) + ½O2(г) = H2O(ж); D H°4 = -285,6 кДж/моль
12. Используя следующие термохимические уравнения
H2(г) + ½O2(г) = H2O(ж) D H°1 = -286 кДж/моль
Na(к)+H2O(ж)(+¥H2O(ж))=NaOH(р-р) + ½H2(г) D H°2 = -231 кДж/моль
Na2O(к) + H2O(ж) (+ ¥ H2O(ж))= 2NaOH(р-р) D H°3 = -282 кДж/моль
С(графит) + O2(г) = CO2(г) D H°4 = -394 кДж/моль
Na2O(к) + CO2(г) = Na2CO3(к) D H°5 = -320 кДж/моль,
вычислите стандартные энтальпии образования Na2O(к), NaOH(р-р) и Na2CO3(к).
13. Вычислить стандартную энтальпию образования I2O5(к), применяя закон Гесса (все величины даны в кДж/моль):
I2O5(к) + H2O(ж) (+ ¥ H2O(ж))= 2HIO3(р-р) D H°1 = +3,6
KI(р-р) + 3HClO(р-р) = HIO3(р-р) + 2HCl(р-р) + KCl(р-р) D H°2 = -322,1
NaOH(р-р) + HClO(р-р) = NaOCl(р-р) + H2O(ж) D H°3 = -44,3
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O(ж) D H°4 = -55,8
2NaOH(р-р) + Cl2(г) = NaOCl(р-р) + NaCl(р-р) + H2O(ж) D H°5 = -99,7
2KI(р-р) + Cl2(г) = 2KCl(р-р) + I2(к) D H°6 = -222,8
H2(г) + ½O2 (г)= H2O(ж) D H°7 = -285,6
½H2(г) + ½Cl2(г) = HCl(г) D H°8 = -92,2
HCl(г) (+ ¥ H2O(ж)) = HCl(р-р) D H°9 = -75,1
Первым следствием из закона Гесса мы будем называть тот замечательный факт, что стандартная энтальпия химической реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных продуктов:

Для реакции вида
аА+вВ=сС+dD D H°298
стандартная энтальпия реакции равна
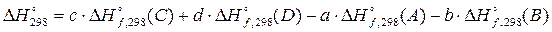 .
.
Здесь следует запомнить, что при работе со стандартной энтальпией образования, из продуктов вычитаются реагенты. Тем, кто не любит запоминать бессмысленные формулы, могу порекомендовать ее запомнить, глядя на схему:

Стандартная энтальпия непосредственной реакции, согласно закону Гесса, равна сумме энтальпий разложения реагентов на простые вещества и формирование из них продуктов реакции. Энтальпия разложения реагентов на простые вещества равна энтальпии образования реагентов с обратным знаком.
Первое следствие из закона Гесса удобно в применении тем, что зная стандартные энтальпии образования веществ (сравнительно небольшое число величин, которые приводят в справочных таблицах) можно вычислить тепловой эффект любой, в том числе и неосуществимой реакции. Стандартная энтальпия образования стала такой же необходимой характеристикой вещества, как его температура плавления или растворимость.
Пример 3
Воспользуемся следствием из закона Гесса, чтобы рассчитать тепловой эффект реакции:
2KClO3(к)=2KCl(к)+3O2(г) D H°298
D H°298 = 2×D H°f,298 (KCl)+3×D H°f,298 (O2)-2×D H°f,298 (KClO3) =
= 2×(-435,9)+3×0-2×(-391,2)= - 89,4 кДж
Иногда в старых справочниках, вместо стандартной энтальпии образования вещества можно встретить стандартную энтальпию его сгорания. Особенно часто стандартную энтальпию сгорания указывают для органических веществ. Действительно, как бы сложно ни была устроена органическая молекула – продукты ее сгорания в избытке кислорода всегда одни и те же: углекислый газ и вода (азот и сернистый газ).
Внимание! Вода в продуктах сгорания берется в жидком состоянии!
На этом свойстве можно составить цикл Гесса:

Возьмем самую вычурную органическую реакцию и сожжем реагенты и продукты в избытке кислорода. Продукты сгорания с обеих сторон уравнения будут одинаковы по составу и количеству, а значит тепловой эффект реакции будет равен сумме тепловых эффектов сжигания реагентов и «собирания» продуктов из оксидов, то есть сжигания продуктов с обратным знаком:
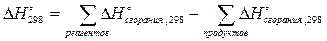
Для реакции вида
аА+вВ=сС+dD D H°298
стандартная энтальпия реакции равна
 .
.
Мы будем называть этот прием вторым следствием из закона Гесса. Следует запомнить, что при расчете энтальпии реакции через стандартные энтальпии сгорания, из реагентов вычитаются продукты.
Обратите внимание, что первое и второе следствия из закона Гесса отличаются знаками, с которыми берутся продукты и реагенты!
Пример 4
Определить стандартную энтальпию реакции при стандартных условиях:

В справочнике находим стандартные энтальпии сгорания всех реагирующих веществ до высших оксидов.
Стандартные энтальпии сгорания воды и углекислого газа, а так же, собственно, кислорода равны нулю, так как эти вещества уже являются высшими оксидами.
 = -1192,9-(-1192,4)-0 = -0,5 кДж/моль
= -1192,9-(-1192,4)-0 = -0,5 кДж/моль
В современных справочниках принято приводить стандартную энтальпию образования, а не сгорания, даже для органических веществ. Но почему не указывают обе величины? Для характеристики вещества достаточно только одной, вторая может быть рассчитана из первой с использованием стандартной энтальпии образования углекислого газа и воды.
Стандартные энтальпии сгорания графита и водорода равны стандартным энтальпиям образования углекислого газа и воды соответственно.
Пример 5
Вычислить стандартную энтальпию образования ацетальдегида, зная его стандартную энтальпию сгорания.
Рассмотрим реакцию образования ацетальдегида из простых веществ и применим второе следствие из закона Гесса:


Пример 6
Вычислить стандартную энтальпию сгорания ацетальдегида, зная его стандартную энтальпию образования.
Рассмотрим реакцию сгорания ацетальдегида и применим первое следствие из закона Гесса:


|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1674; Нарушение авторских прав?; Мы поможем в написании вашей работы!