
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость теплового эффекта реакции от температуры проведения процесса. Теплоемкость
|
|
|
|
Задачи
48. Используя следующие данные
D H ° f ,298(KOH(к))= -424,67 кДж/моль;
D H ° f ,298(KOH(р-р,1000 Н2О))= -481,92 кДж/моль,
вычислить количество теплоты, которое выделиться при растворении 5,6 г гидроксида калия в 1800 г воды.
49. Сколько теплоты выделится при сгорании 10 г сероуглерода в стандартных условиях? Для решения задачи воспользуйтесь справочными данными.
50. Какое количество теплоты выделится при сгорании 10 л этилена (27°С и 98,64 кПа), если стандартная энтальпия его образования 52,3 кДж/моль?
51. При сгорании 1 л ацетилена (0°С и 101,3 кПа) выделяется 58,2 кДж. Вычислите D H°f,298 ацетилена.
52. Вычислите стандартную энтальпию образования пропана, если известно, что при сгорании 11 г пропана при постоянном давлении 1 атм. и температуре 298К выделилось 552 кДж теплоты.
53. Какую массу угля потребуется сжечь, чтобы нагреть 1 л воды от 20 до 100°С?
54. Определите стандартную энтальпию реакции взаимодействия Fe2O3 и алюминия с образованием Al2O3 и железа, если стандартные энтальпии образования Fe2O3(кр) и Al2O3 (кр) равны соответственно -822,2 и -1669,8 кДж/моль. Рассчитайте, какое количество теплоты выделится в расчете на 1 г Fe2O3 и на 1 г Al.
55. Какое количество теплоты выделится при окислении 1 г оксида мышьяка (III) озоном? 3As2O3(к)+ 2O3(г)= 3As2O5(к)
| As2O3(к) | O3(г) | As2O5(к) | |
| D H ° f ,298 кДж/моль | -666 | -143 | -925 |
56. Стандартные энтальпии образования CH4(г), CO2(г), H2O(г) равны -78, -395, -242 кДж/моль соответственно. Рассчитайте: а) теплотворную способность метана, выраженную в МДж/м3; б) количество теплоты, которое выделится при полном сгорании 20 м3 метана, взятого, при 25°С и давлении 1 атм. (При расчетах следует считать, что вода образуется в парообразном состоянии.)
57. В каких массовых соотношениях следует смешать древесный уголь с известняком, чтобы получение негашеной извести протекало после начала процесса без подвода тепла извне? Содержанием примесей и возможностью протекания побочных процессов пренебречь. При расчете необходимо учесть, что потери теплоты в процессе составляют 40%.
58. Стандартные энтальпии сгорания D H °сг,298 (кДж/моль) некоторых газов приведены ниже:
а) метан (г) -890 г) н -бутан (г) -2874
б) этан (г) -1558 д) н -пентан (г) -3533
в) пропан (г) -2218 е) н -гексан (г) -4191
А) Вычислите теплотворную способность горючего газа (в МДж/м3) и стандартную энтальпию его образования.
B) Постройте график зависимости стандартной энтальпии сгорания от числа атомов углерода в молекуле. Объясните полученную зависимость.
59. Какая горелка выделяет больше теплоты: работающая на водороде, метане или ацетилене?
а) Найдите тепловые эффекты сгорания указанных соединений в расчете на 1 моль, 1 кг и 1л (25ºС) исходного горючего газа.
б) Рассчитайте тепловой эффект в расчете на 1 л стехиометрической смеси горючего газа с воздухом и с кислородом.
в) Выпишите из справочника температуру пламени указанных газов. Сравните тепловые эффекты с температурой пламени и прокомментируйте полученные цифры.
60. Используя величины стандартных энтальпий образования следующих веществ
| CO2(г) | H2O(ж) | C6H6(ж) | |
| D H ° f ,298 кДж/моль | -393,5 | -285,6 | +48,0 |
Вычислить количество теплоты, выделяющееся при сгорании 10,0 г жидкого бензола.
61. При растворении 4 г безводного сульфата меди в большом количестве воды выделяется 1680 Дж теплоты. При растворении 5 г пентагидрата сульфата меди в том же количестве воды поглощается 227 Дж теплоты. Вычислите D H °298 процесса CuSO4(к)+5H2O(ж)= CuSO4·5H2O(к)
62. Тепловой эффект сгорания 10,0 г ацетилена в калориметрической бомбе при постоянном объеме и 298 К, равен 500,6 кДж. Вычислите D H°298 и D U°298 а) сгорания б) образования ацетилена.
63. При сжигании 2,3 г этилового спирта в калориметрической бомбе, помещенной в калориметр с водой, температура воды повысилась на 5,72°С. Измерения проводили при 25°С. Суммарная теплоемкость воды и калориметрической бомбы равна 12 кДж/°С. Вычислите а) энтальпию сгорания этилового спирта при постоянном объеме; б) энтальпию сгорания этилового спирта при постоянном давлении (вода и спирт – жидкости, газы считать идеальными).
64. При взаимодействии 10 г металлического натрия с водой выделяется 79,910 кДж, а при взаимодействии 20 г оксида натрия с водой выделяется 76,755 кДж. В обоих случаях вода берется в большом избытке. Вычислить стандартную энтальпию образования оксида натрия.
65. При полном сгорании 54,1 г смеси жидких метанола, этанола и циклогексана выделилось 2213,6 кДж теплоты и образовалось 75,04 л (н.у.) углекислого газа. Найти массовые доли веществ в исходной смеси, если
| CH3OH(ж) | C2H5OH(ж) | C6H12(ж) | |
| D H ° сгор,298 кДж/моль | -725 | -1367 | -3918 |
66. При сжигании некоторого количества смеси серы и фосфора в избытке кислорода выделилось 313 кДж теплоты, а на полную нейтрализацию продуктов сгорания потребовалось 246 мл водного раствора едкого натра, с массовой долей w=20% (r=1,22г/мл). Вычислить массовые доли серы и фосфора в смеси, если D H ° f ,298(P2O5(к))= -1492 кДж/моль, а D H ° f ,298(SO2(г))= -297 кДж/моль.
67. При сжигании паров этилацетата в кислороде выделилось 410,9 кДж теплоты, при этом осталось 12,2 л (105 кПа; 35,3°С) непрореагировавшего кислорода. Вычислить массовые доли компонентов в исходной смеси, если величины D H ° f ,298 для CO2(г), H2O(г) CH3COOC2H5(г) составляют соответственно -393,5; -241,8; -486,6 кДж/моль.
68. При сжигании смеси метана и этана выделилось 476,2 кДж теплоты и образовалось 13,44 л (н.у.) углекислого газа. Определите объемную долю метана в смеси.
| CO2(г) | H2O(ж) | CH4(г) | C2H6(г) | |
| D H ° f ,298 кДж/моль | -393,5 | -285,6 | -74,8 | -84,7 |
69.  При нагревании 1,5 моль брома с избытком пропана образовалось два монобромпроизводных и поглотилось 23,7 кДж. При нагревании такого же количества вещества исходной смеси до более высокой температуры поглотилось 23,9 кДж. В обоих случаях бром прореагировал полностью. Известно, что при образовании 1-бромпропана из простых веществ выделяется на 2 кДж/моль меньше, чем при образовании 2-бромпропана. Найдите стандартные энтальпии обеих реакций и выход 1-бромпропана во второй реакции, если в первой реакции он составил 40%. Стандартные энтальпии реакций можно считать не зависящими от температуры.
При нагревании 1,5 моль брома с избытком пропана образовалось два монобромпроизводных и поглотилось 23,7 кДж. При нагревании такого же количества вещества исходной смеси до более высокой температуры поглотилось 23,9 кДж. В обоих случаях бром прореагировал полностью. Известно, что при образовании 1-бромпропана из простых веществ выделяется на 2 кДж/моль меньше, чем при образовании 2-бромпропана. Найдите стандартные энтальпии обеих реакций и выход 1-бромпропана во второй реакции, если в первой реакции он составил 40%. Стандартные энтальпии реакций можно считать не зависящими от температуры.
При термохимических расчетах широко используется то свойство, что
тепловой эффект химической реакции мало зависит от температуры проведения процесса.
В большинстве расчетов мы пренебрегаем зависимостью D H °(T). Однако для более точных расчетов эту зависимость следует учесть. Изменение теплового эффекта химической реакции в зависимости от температуры выражается законом Кирхгофа:
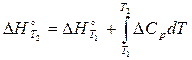 ,
,
где DСр – разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ, взятых с учетом стехиометрических коэффициентов. Для реакции вида
аА+вВ=сС+dD
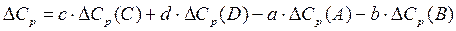 .
.
Этот закон дает возможность вычислять тепловые эффекты реакций при любых температурах, если известны зависимости теплоемкостей всех исходных веществ и продуктов реакции от температуры.
Если в температурном интервале T1-T2 происходит фазовое превращение, то интегрирование следует провести от Т1 до температуры фазового перехода, затем прибавить тепловой эффект фазового превращения при этой температуре и далее взять интеграл от температуры фазового превращения до температуры Т2.
Как на практике удобно вычислять энтальпию реакции при температуре отличной от стандартной? В справочниках обычно приводится значение молярной изобарной теплоемкости веществ при температуре 298К. (Иногда приводят и коэффициенты температурной зависимости Ср.) Обычно мы вообще пренебрегаем зависимостью энтальпии от температуры, при желании же ее учесть, мы можем воспользоваться точной, но достаточно сложной формулой Кирхгофа либо воспользоваться новым приближением. Учитывая зависимость энтальпии от температуры D H °(T), пренебрежем зависимостью теплоемкости от температуры D Ср (T), тогда константа выносится из-под знака интегрирования, и мы получаем простую зависимость:
 ,
,
Пример 20
Определить величину D H °1000 для реакции получения порошка графита
4K(г)+CCl4(г)=4KCl(кр)+C(графит)
| K(г) | CCl4(г) | 4KCl(кр) | C(графит) | |
| D H ° f,298 кДж/моль | -107 | -436 | ||
| Ср,298 Дж/моль×К | - | 83,4 | 51,5 | 8,5 |
Определим энтальпию реакции при стандартных условиях:
D H ° 298 =0+4×(-436)-4×90-(-107)= -1997 кДж/моль.
Чтобы определить DСр,298 не хватает данных о теплоемкости газообразного калия. Вместо отсутствующих экспериментальных данных мы можем воспользоваться теоретическим представлением о том, что
изобарная молярная теплоемкость одноатомных газов близка к 5/2R.
Тогда Ср,298(К(г))=5/2×8,31 Дж/моль×К=20,8 Дж/моль×К.
Упомянем еще несколько полезных соотношений:
изобарная молярная теплоемкость газов, состоящих из жестких двухатомных молекул (с замороженным колебанием) близка к 7/2R.
Молярная теплоемкость металлов(кр) при обычных и высоких температурах близка к 3R.
DСр,298=8,5+4×51,5-83,4-4×20,8=47,9 Дж/моль×К
Обратите внимание, что
изобарная молярная теплоемкость простых веществ не равна нулю.
D H ° 1000 =D H ° 298 +DСр,298×DТ= -1997 кДж/моль+47,9 Дж/моль×К×(1000-298)К=
= -1997 кДж/моль+33626Дж/моль= -1997 кДж/моль+33,6Дж/моль=
= - 1963 кДж/моль
Хочется отметить, что полученная величина D H ° 1000 лишь на 2% отличается от D H ° 298. Для многих задач такая разница не существенна, и зависимость энтальпии от температуры можно не учитывать.
Внимание! Если Вы получили большую зависимость энтальпии от температуры, проверьте, что Вы перевели Дж в кДж.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1981; Нарушение авторских прав?; Мы поможем в написании вашей работы!