
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественные расчеты
|
|
|
|
Задачи
40. Энтальпия образования C2H5OH(г) в стандартных условиях равна -235 кДж/моль. Рассчитайте энтальпию сгорания одного моля паров этилового спирта. Вычислите энтальпию этого же процесса, используя значения энергий связей (кДж/моль): eC-C=262; eC-H=358; eC=O=730; eO=O=491; eO-H=460; eC-O=314. Сравните полученную величину с величиной, рассчитанной на основе энтальпий образования в стандартных условиях.
41. Энергия связи N-F в молекуле NF3 составляет 281 кДж/моль. Рассчитайте стандартную энтальпию образования трифторида азота, если энергии связей в молекулах N2 и F2 составляют соответственно 945 и 159 кДж/моль.
42. Стандартная энтальпия образования NH3 составляет 46 кДж/моль. Рассчитайте энергию связи N-H в молекуле аммиака, если энергии связей в молекулах H2 и N2 составляют соответственно 436 и 945 кДж/моль.
43. Рассчитайте энергию связи H-Br, исходя из следующих данных: стандартное изменение энтальпии при образовании HBr из газообразного водорода и жидкого брома равно -36,4 кДж/моль; стандартная энтальпия испарения брома составляет 15,4 кДж/моль; стандартные энтальпии диссоциации водорода и газообразного брома равны соответственно 432,2 и 192,4 кДж/моль.
44. Определите энергию P-P связи в тетраэдрической молекуле фосфора и в двухатомной молекуле фосфора.Сравните с энергией связи в молекуле азота. Как Вы думаете, почему азот не образует тетраэдрических молекул?
| P(г) | P2(г) | P4(г) | N(г) | |
| D H°f, кДж/моль | 316,4 | 143,8 | 59,0 | 472,70 |
45. Энергия кристалличской решетки С(алмаз) составляет 715 кДж/моль, а энергия кристаллической решетки SiC (алмазоподобной) составляет 1250 кДж/моль. Почему энергия кристаллической решетки во SiC настолько превышает энергию кристаллической решетки алмаза?
46. Потенциал ионизации атомарного водорода равен 13,6 эВ, а его сродство к электрону 0,75 эВ. Для молекулярного водорода эти величины, соответственно, равны 15,43 эВ и – 0,72эВ. Определить величины энергии связи в частицах Н2+ и Н2- (в кДж/моль). Энергия связи в молекуле водорода составляет 436 кДж/моль.
47. У фтора абсолютное значение сродства к электрону меньше, чем у хлора (330,2 и 349,0 кДж/моль соответственно), а энтальпия образования KF(к) по абсолютному значению больше энтальпии образования KCl(к). Объясните этот факт. Составьте на единой энергетической шкале циклы Борна-Габера для обеих решеток.
Количество теплоты, поглотившееся или выделившееся во время химической реакции пропорционально количествам прореагировавших веществ. Для поглощенной теплоты выполняется соотношение:
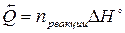
Количество выделившейся теплоты имеет обратный знак:
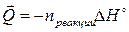
Так как D Н° указывается для химической реакции с учетом стехиометрических коэффициентов, под n реакции подразумевается количество веществ с учетом этих стехиометрических коэффициентов. Для реакции вида
аА+вВ=сС+dD D H°298
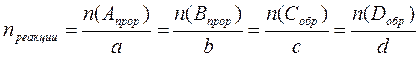
Пример 19
Рассчитать количество теплоты, выделившееся при взаимодействии 1 л водорода с избытком азота с образованием аммиака при стандартных условиях.
N2(г)+3H2(г)«2NH3(г) D Н°
Стандартное изменение энтальпии в ходе реакции образования аммиака из простых веществ равно для данной формы записи уравнения удвоенной стандартной энтальпии образования аммиака: D Н°=2× D Н°f,298 (NH3(г)). «Количество прошедшей реакции», т.е. n реакции, которому соответствует D Н° в три раза меньше, чем количество водорода: n реакции =n(H2)/3.
При расчете количества вещества водорода, следует учесть, что молярный объем Vm=22,4 л/моль, к которому мы привыкли, правомерно использовать только при нормальных условиях, которые отличаются от стандартных условий, принятых в термодинамике. (Избалованные химики, видите ли, желают проводить реакции при комфортной стандартной температуре 25°С, а не при «нормальных» условиях 0°С, выбранных физиками.) С помощью уравнения Менделеева-Клайперона мы может рассчитать количество вещества для любых условий.
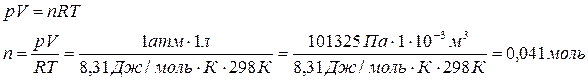
Удобно, также, ввести молярный объем для стандартных условий, чтобы использовать его в других задачах:
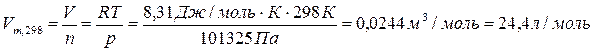
n реакции =n(H2)/3= 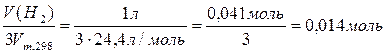
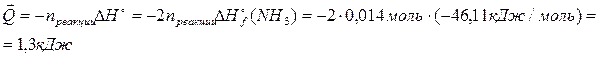
Итак, при образовании аммиака из 1 л водорода выделилось 1,3 кДж.
Вам знакомо большое разнообразие задач по химии, где используется знание количества вещества. Все эти задачи могут содержать в себе этап вычисления количества вещества через известный тепловой эффект реакции.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2325; Нарушение авторских прав?; Мы поможем в написании вашей работы!