
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия связи, энергия кристаллической решетки
|
|
|
|
Задачи
31. Стандартные энтальпии растворения SrCl2(к) и SrCl2·10H2O(к) составляют соответственно -47,7 и 31,0 кДж/моль. Вычислите изменение энтальпии в реакции
SrCl2(к) + 10H2O(ж) = SrCl2·10H2O(к)
32. Стандартная энтальпия растворения CuSO4(к) составляет -66,1 кДж/моль, а энтальпия перевода CuSO4(к) в CuSO4·5H2O(к) равна -78,8 кДж/моль. Вычислите стандартную энтальпию растворения CuSO4·5H2O(к).
33. Используя справочные данные о стандартной энтальпии образования ионов в водном растворе, вычислите стандартную энтальпию растворения следующих веществ:
| NaCl | NaNO3 | NH4Cl | NH4NO3 | ||||
| CaCl2 | Ca(NO3)2 | AgCl | AgNO3 |
34. Используя следующие данные
H2O(ж)=H+(р-р)+OH-(р-р) D H° 298 = +56,9 кДж/моль;
D H°f, 298 (H2O(ж))= -285,6 кДж/моль;
D H°f, 298 (Na+(р-р))= -240,6 кДж/моль,
вычислить величину D H°f 298 (NaOH(р-р))
35. При 298 К стандартные энтальпии образования газообразного и жидкого аммиака соответственно равны - 46,19 и -69,87 кДж/моль. Чему равна стандартная энтальпия растворения жидкого аммиака в 200 моль воды, если стандартная энтальпия растворения газообразного аммиака в том же количестве воды равна - 34,90 кДж/моль?
36. Вычислить D H °298 процесса Na2SO3(к)+7H2O(ж)=Na2SO3×7H2O(к),
Используя следующие данные:
| Na2SO3×7H2O(к) | H2O(ж) | Na+ (р-р,¥ H2O) | SO32- (р-р,¥ H2O) | |
| D H ° f ,298 кДж/моль | -3153,97 | -285,6 | -240,41 | -641,0 |
Стандартная энтальпия растворения Na2SO3(к) равна -26,82 кДж/моль.
37. Вычислить стандартную энтальпию растворения хлорида алюминия, используя следующие данные:
| AlCl3×6H2O(к) | H2O(ж) | Al3+ (р-р,¥ H2O) | Cl- (р-р,¥ H2O) | |
| D H ° f ,298 кДж/моль | -2691,6 | -285,6 | -529,7 | -233,62 |
AlCl3(к)+6H2O(ж)=AlCl3×6H2O(к) D H° 298 = -272,42кДж/моль
38. Стандартные энтальпии растворения едкого кали, соляной кислоты и хлорида калия равны соответственно - 53,80, -73,51 и +18,55 кДж/моль. Найти стандартные энтальпии образования этих растворов, если стандартные энтальпии образования KOH(тв), HCl(г) и KCl(тв) соответственно равны -426,44, -92,21 и -435,43 кДж/моль. Рассчитайте стандартную энтальпию нейтрализации раствора гидроксида калия раствором соляной кислотой. Стандартную энтальпию образования воды примите равной -285,56кДж/моль.
39. Попробуйте объяснить следующие факты, связанные с тепловыми эффектами растворения в воде некоторых веществ:
Факт 1. Стандартная энтальпия растворения в воде серной кислоты (в расчете на 1 моль кислоты) сильно зависит от соотношения H2SO4 и H2O:
| n(H2O)/n(H2SO4) | 0,5 | ¥ | |||||
| D H °, кДж/моль | -15,7 | -28,1 | -58 | -67 | -73,3 | -78,6 | -96,2 |
Факт 2. Сульфат меди образует несколько кристаллогидратов, стандартные энтальпии растворения которых в одинаковом (800-кратном) избытке воды не только сильно различаются, но даже меняют знак:
| Вещество | CuSO4(тв) | CuSO4×3H2O(тв) | CuSO4×5H2O(тв) |
| D H °, кДж/моль | -66,5 | -15,1 | +11,7 |
Факт 3. При растворении зеленых кристаллов CuCl2×2H2O в небольшом объеме воды раствор охлаждается. Когда мольный избыток воды по отношению к хлориду меди достигает 14, процесс становится термонейтральным. При мольном избытке воды более 14 растворение экзотермическое (раствор нагревается).
Энергией химической связи называют изменение стандартной энтальпии при разрыве связи, например:
Н2(г)=2Н(г) D Н°298 =Есв(Н-Н).
Здесь мы ввели в рассмотрение новые частицы – индивидуальные атомы в газообразном состоянии. Эти частицы удобны для рассмотрения, их значения стандартной энтальпии образования приводят в справочных таблицах.
Пример 14
Рассчитаем энтальпию фазового перехода
Na(к)=Na(г)
D H°298,возгонки =D H°f,298 (Na(г))-D H°f,298 (Na(к))= 108,3-0=108,3 кДж
Энергия связи важная величина, с помощью нее можно получить представление о некоторых свойствах соединения: его устойчивости, реакционноспособности и пр. Некоторые энергии связей удается измерить экспериментально, например энергии диссоциации двухатомных молекул, некоторые можно определить с помощью термохимических расчетов.
Пример 15
Вычислить энергию химической связи H-Cl в молекуле хлороводорода, по известной энтальпии образования D H°f,298 (HCl(г))= -92,8 кДж/моль и энергиям диссоциации молекул D H°диссоц (Cl-Сl)=242,6 кДж/моль, D H°диссоц (H-H)=435,0 кДж/моль на атомы.
Образование молекул хлороводорода из простых веществ можно мысленно разбить на стадии: диссоциация молекул хлора и водорода на атомы и образование хлороводорода из атомов.

В соответствии с законом Гесса,
D H°диссоц (H-H)+ D H°диссоц (Cl-Cl)=2D H°f,298 (HCl(г))+2 Eсв(Cl-H),
откуда
Eсв(Cl-H)= ½ D H°диссоц (H-H) +½ D H°диссоц (Cl-Cl)-D H°f,298 (HCl(г))=
= ½×(242,6+435,0)- (-92,8)= 431,6 кДж/моль
Наоборот, зная энергию связей, можно рассчитать энтальпию химической реакции. Анализируя цикл Гесса, представленный ниже в общем виде, сформулируем третье следствие из закона Гесса:
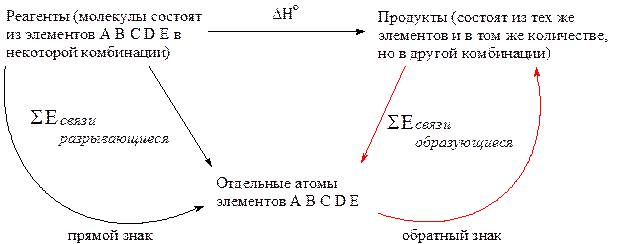
Изменение энтальпии в ходе химической реакции равно сумме энергий разрывающихся связей (затраченная энергия) за вычетом суммы энергий образующихся связей (выделившаяся энергия):

Но встает вопрос, уж если удалось определить энергии связей в соединении, то наверняка известна его стандартная энтальпия образования. Зачем использовать энергии связей? Действительно, третье следствие из закона Гесса было бы малоценным, если бы не один замечательный факт:
В однотипных соединениях энергии подобных связей близки по значению.
Особенно это свойство ценно для органических соединений. Оказывается, что энергия связи С-Н или одинарной С-С связи не сильно зависит от окружения. Значит, вычислив энергии связей для простых соединений, мы можем предположить, что и в более сложных соединения их значения остаются примерно такими же. Это позволяет, пользуясь третьим следствием из закона Гесса, оценивать тепловые эффекты сложных органических реакций.
Средние значения энергии связей в органических соединениях представлены в Табл. 2.
Табл. 2
| кДж/моль | кДж/моль | ||
| С-Н | 358,2 | С=О в кетонах | 652,7 |
| С-С | 262,8 | С-О в спиртах | 313,8 |
| С=С | О-Н | 418,4 | |
| СºС | 536,4 | С=О в СО2 | 702,9 |
Пример 16
Определить тепловой эффект реакции, протекающей в газовой фазе:

Как Вы догадываетесь, воспользоваться первым и вторым следствием из закона Гесса в этом случае не удастся, так как в справочнике отсутствуют значения энтальпии образования или сгорания конечного продукта реакции. Воспользуемся данными об энергиях связей (Табл. 2).

Мы, как и при иллюстрации третьего следствия, полностью разложили исходные соединения на атомы и собрали из них продукты. Но этого делать не обязательно. Достаточно определить, какие связи при реакции разрываются, и какие новые связи образуются, не трогая куски молекул, не претерпевающие изменений. К тому же результату мы придем, если сократим предыдущее выражение:
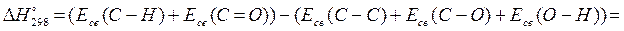
=358,2+652,7-262,8-313,8-418,4= 15,9 кДж/моль
Для количественной характеристики прочности кристаллических соединений используется представление об энергии кристаллической решетки. Энергией кристаллической решетки называют изменение стандартной энтальпии в процессе перевода 1 моль атомов, молекул или структурных единиц кристаллического вещества в газообразное состояние. При этом под газообразным состоянием подразумевается только удаление частиц на значительное расстояние друг от друга, а не реальный состав газовой фазы над кристаллом. То есть, для молекулярных и координационных соединений это молекулы и атомы, частицы реально присутствующие в газовой фазе, а для ионного кристалла – отдельные ионы, частицы, которые практически не присутствуют в парах ионных соединений.
Для многих металлов, координационных и молекулярных соединений энергия кристаллической решетки может быть рассчитана непосредственно из экспериментальных данных о теплотах сублимации (см Пример 14). Иногда, когда непосредственное определение затруднительно, требуется термохимический расчет.
Пример 17
Рассмотрим в качестве примера определение энергетических характеристик алмаза.
Алмаз – термодинамически неустойчивая модификация углерода при атмосферном давлении и любых температурах, и он должен самопроизвольно переходить в графит – устойчивую модификацию углерода. Не происходит этого лишь за счет высокого активационного барьера перехода алмаза в графит, а значит и низкой скорости процесса перехода. При низких температурах алмаз кинетически устойчив. При высоких температурах скорость процесса
С(алмаз)=С(графит)
многократно возрастает, и алмаз превращается в графит. Заметная атомизация углерода, происходит, разумеется, при еще более высоких температурах.
Определить экспериментально энтальпию сублимации (атомизации) алмаза
С(алмаз)=С(газ)
невозможно, так как при низких температурах возникает проблема с наличием газовой фазой углерода, а при высоких температурах возникает проблема с существованием углерода в виде алмаза.
Чтобы иметь возможность экспериментально определить энтальпию сублимации алмаза, составим цикл Гесса:
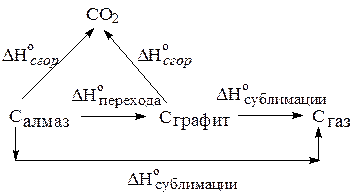
Энтальпия сублимации графита может быть определена при высоких температурах D H°субл (С(графит))=715,0 кДж/моль. Энтальпию перехода из алмаза в графит можно определить по разности экспериментально определяемых энтальпий сгорания алмаза и графита (см задачу 1.) D H°перехода = -1,9 кДж/моль. Получаем
D H°субл (С(алмаз))=D H°перехода +D H°субл (С(графит))= -1,9+715,0=
=713,1 кДж/моль.
Таким образом, на переход атомов углерода из структуры алмаза в состояние отдельных атомов, то есть на разрыв всех связей в кристаллической решетке, потребуется D H°кр =713,1 кДж/моль.
Какова энергия С-С связей в алмазе? Каждый атом углерода связан четырьмя химическими связями с соседями. Следует также учесть, что
каждая химическая связь соединяет два атома,
то есть, химических связей в структуре алмаза лишь в два (а не в четыре) раза больше, чем атомов. Так как энергия 713,1 кДж/моль приходится на разрыв 2 молей связей С-С, то энергия связи составит
Есв(С-С)=713,1/2=356,6 кДж/моль.
Экспериментально определить энергию кристаллической решетки ионного соединения очень сложно. Ее можно вычислить посредством термодинамического цикла (цикла Борна-Габера), воспользовавшись другими известными энтальпиями превращений, которым может подвергаться исследуемое ионное соединение.
Пример 18
Рассмотрим способ расчета энергии кристаллической решетки D H°кр кристаллического хлорида натрия.
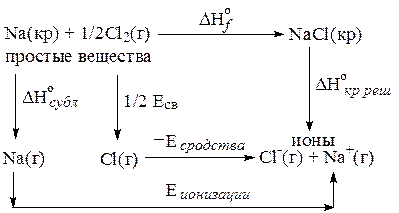
Найти изменение энтальпии процесса
NaCl(кр)=Na+(г)+Cl-(г) D H°кр
можно через сумму пяти промежуточных стадий:
§ разложение NaCl на простые вещества
NaCl(кр)=Na(кр)+ ½Cl2(г) -D H°f (NaCl);
§ перевод металлического натрия в газообразное состояние
Na (кр)=Na (г) D H°сублимации;
§ диссоциации молекулярного хлора на атомы
½Cl2(г)= Cl (г) ½Eсв(Сl-Cl),
здесь требуется еще раз отметить, что, так как каждая связь соединяет два атома, то для получения 1 моль атомов требуется порвать только ½ моль связей;
§ отрыв электрона от атома натрия
Na (г)=Na+ (г) + е- Еион.
Отрыв электрона от атома или иона характеризуется такой величиной, как энергия ионизации первая, вторая и т.д.. Как правило эти величины измеряют физики, поэтому и указывают они их в своих любимых единицах измерения – эВ.
1 электрон-Вольт эта такая энергия, которую приобретает электрон при прохождении разницы потенциалов 1 В.
Так как E=qDV=eDV=1,6×10-19Кл×1В=1,6×10-19Дж=1,6×10-19Дж×Na=
=1,6×10-19Дж×6,02×1023 моль-1=96,3 кДж/моль.
1эВ=1,6×10-19Дж (численно равен заряду электрона)
1эВ=96,3 кДж/моль (один электрон-Вольт около ста кДж/моль)
Иногда в справочниках вместо энергии ионизации приводят потенциалы ионизации (в Вольтах). Численно они совпадают с энергией ионизации (в эВ).
§ присоединение электрона к атому хлора
Cl(г) + е-= Cl-(г) DH°= -Есродства
Здесь следует отметить, что под энергией сродства к электрону подразумевается энергия выделившаяся при присоединении электрона к электронейтральному атому. Так как под изменением энтальпии подразумевается поглотившаяся энергия, мы вынуждены взять энергию сродства с обратным знаком.
Просуммировав все промежуточные этапы, мы получаем
D H°кр = -D H°f (NaCl)+ D H°сублимации +½Eсв(Сl-Cl)+ Еион (Na) -Есродства =
= - (-413 кДж/моль) + 109 кДж/моль +½×238 кДж/моль +5,14 эВ-
-3,82 эВ= 641 кДж/моль +1,32эВ×96,3  =768 кДж/моль.
=768 кДж/моль.
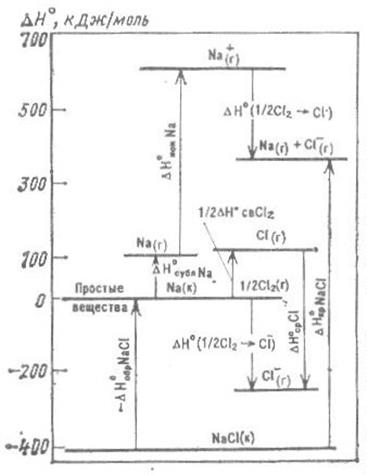
Цикл Борна-Габера удобно также представлять на энергетической диаграмме (Рис. 1)
Рис. 1 Энтальпийная диаграмма перехода кристаллического хлорида натрия в изолированные ионы.
Зная энергию кристаллической решетки ионных соединений, можно вычислить такую интересную величину, как энтальпия гидратации ионов. Растворение ионного соединения в воде можно последовательно представить как разрушение кристаллической решетки и взаимодействаие полученных ионов с водой, т.е. их гидратацию (сольватацию).

SD H°гидратации = D H°растворения -D H°крист.решетки
При расчете по данному уравнению находят суммарное значение энтальпии гидратации катиона и аниона. Энтальпии гидратации отдельных ионов можно вычислить, сопоставляя данные по нескольким солям.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 6070; Нарушение авторских прав?; Мы поможем в написании вашей работы!