
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпия растворения
|
|
|
|
Задачи
24. Стандартные энтальпии образования CO(г) и CO2(г) при 298 К равны соответственно -110,5 и -393,5 кДж/моль (при постоянном давлении). Вычислить D U°f,298 (при постоянном объеме).
25. Пользуясь справочными данными, найти изменение внутренней энергии D U° 298 в ходе реакций, указанных в задаче №21 (при р=1 атм, T=298K).
26. Вычислить стандартную внутреннюю энергию образования органических веществ, указанных в задаче №22 взяв из справочника их стандартные энтальпии образования и считая газы идеальными, а жидкости и твердые тела несжимаемыми.
27. Вычислить стандартную внутреннюю энергию сгорания органических веществ, указанных в задаче №22, взяв из справочника их стандартные энтальпии сгорания и считая газы идеальными, а жидкости и твердые тела несжимаемыми.
28. Вычислить стандартную внутреннюю энергию сгорания органических веществ, указанных в задаче №20, взяв из справочника их стандартные энтальпии образования и считая газы идеальными, а жидкости и твердые тела несжимаемыми.
29. Величины стандартных энтальпий сгорания веществ при постоянном давлении приведены ниже в единицах кДж/моль. На сколько процентов больше будет выделяться теплоты при сгорании их в условиях постоянного объема?
а) Метан, СН4(г) – 838; д) Формамид, HCONH2(ж) – 500;
б) Метанол, СН3ОН(ж) – 636; е) Пентаборан, B5H9(ж) – 4200;
в) Метилнитрат, СН3NO3(ж) – 595; ж) Сероуглерод, СS2(г) – 519;
г) Дихлорметан, СН2Сl2(ж) – 460; з) Тиомочевина, SC(NH2)2(кр) – 969.
30. При сгорании нафталина C10H8(к) в калориметрической бомбе (V=const) при 298 К с образованием воды и углекислого газа величина D U °298= -5157,72 кДж/моль. Вычислить стандартную энтальпию сгорания нафталина при постоянном давлении 1 атм.
|
|
|
Применение циклов Гесса для расчетов теплот неизвестных процессов оказалось настолько удобным, что стандартную энтальпию образования приводят не только для индивидуальных веществ, но и для некоторых частиц: ионов в растворе, атомов. Это позволяет рассчитывать тепловые эффекты не только химических реакций, но и самых разных процессов.
В справочниках приводят стандартные энтальпии образования ионов в бесконечно разбавленном водном растворе. Что подразумевается под этой величиной? Ведь из простых веществ ионы не получишь, взять к примеру образование иона Сl-:
½Cl2+e (+ ¥ H2O(ж))=Cl-(р-р)
Для образования хлорид-иона в растворе кроме простых веществ и среды требуется такая непонятная вещь, как дополнительный электрон. Как же определяют стандартные энтальпии образования ионов?
Энтальпия величина относительная. На практике мы можем измерить лишь изменение энтальпии в ходе тех или иных процессов. Естественной точки отсчета для энтальпии не существует. Для собственного удобства химики договорились считать точкой отсчета – нулем, значения энтальпий образования простых веществ. Так как превращений одних элементов в другие в ходе химических процессов не происходит, то элементы, для химиков, не связаны между собой никакими тепловыми соотношениями. Поэтому независимых точек отсчета, то есть нулей, мы имеем ровно столько, сколько элементов.
При желании расширить определение стандартной энтальпии образования на ионы, возникает еще один «элемент» - заряд или электрон. Вместе с «лишним» элементом возникает необходимость выбрать дополнительную точку отсчета. Нулем может стать любая величина, связанная с зарядом. Химики сочли удобным в качестве дополнительного нуля выбрать ×D H°f,298 (Н+(р-р))=0.
Стандартная энтальпия образования иона водорода в бесконечно разбавленном водном растворе по определению равна нулю.
|
|
|
Все остальные значения стандартных энтальпий образования ионов, рассчитываются, исходя из тепловых эффектов физико-химических процессов и этого определения (см Пример 9).
С помощью стандартных энтальпий образования ионов можно приблизительно рассчитывать тепловые эффекты растворения веществ в воде.
Пример 10
Рассчитаем тепловой эффект растворения КОН:
КОН(к)=К+(р-р)+ОН-(р-р)
D H°298,растворения =D H°f,298 (K+(р-р))+D H°f,298 (ОН-(р-р))- D H°f,298 (KОН(к))=
= -251,2+(-230,2)-(-425,8)= - 55,6 кДж/моль
Гидроксид калия растворяется в воде с заметным экзотермическим эффектом. Раствор при этом нагревается.
Пример 11
Рассчитаем тепловой эффект растворения КI:
КI(к)=К+(р-р)+I-(р-р)
D H°298,растворения =D H°f,298 (K+(р-р))+D H°f,298 (I-(р-р))- D H°f,298 (KI(к))=
= -251,2+(-55,9)-(-327,7)= + 20,6 кДж/моль
Иодид калия растворяется в воде с заметным эндотермическим эффектом. При растворении KI в воде, раствор охлаждается.
Почему же мы говорим лишь о приблизительном расчете теплового эффекта, а не о точном? Для более точных расчетов следует учесть, что тепловой эффект растворения веществ зависит от концентрации раствора. Например, для соляной кислоты и гидроксида калия см Табл. 1.
 Табл. 1
Табл. 1
| Число молей H2O на 1 моль вещества | ¥ | |||||
| HCl D H°298 кДж/моль | -26,2 | -69,5 | -73,8 | -74,7 | -75,0 | -75,1 |
| КОН D H°298 кДж/моль | -52,7 | -54,5 | -54,9 | -55,2 | -55,3 |
Чем в большем количестве воды мы растворяем вещество, тем больший суммарный тепловой эффект мы получаем. Причем, тепловой эффект при разведении концентрированных растворов будет больше, чем тепловой эффект при таком же разведении разбавленных растворов. При достаточно большом разбавлении мы приходим к некоторому пределу, при котором дальнейшее разбавление не оказывает теплового эффекта. Именно для этого предела и указываются значения D H°f,298 (ионы или в-во (р-р)). Для точных расчетов тепловых эффектов растворения следует обращаться к справочным данным, подобным тем, что приведены в Табл. 1.
Пример 12
Определить тепловой эффект разбавления раствора КОН от концентрации 24% до концентрации 3%.
Произведем перерасчет концентраций к форме, приведенной в Табл. 1. Возьмем 100 г 24%-ного раствора. Он состоит из 100 г × 0,24=24 г гидроксида калия и 100г-24г=76 г воды. Количества веществ гидроксида калия n(KOH)=24г/56г/моль=0,43 моль и воды n(H2O)=76г/18г/моль=4,22 моль соотносятся как 1:10.
|
|
|
Аналогичный расчет производим для 3%-ного раствора
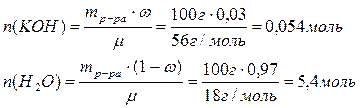
Количества веществ гидроксида калия и воды соотносятся как 1:100.
Для определения теплового эффекта разбавления раствора составим цикл Гесса:
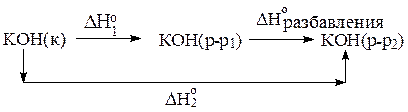
Из схемы видно, что
D H°298,разбавления =D H°f,298 (KOH(р-р 1:100))- D H°f,298 (KOH(р-р 1:10))=
= -54,5 -(-52,7)= - 1,8 кДж/моль.
Следует обратить внимание на то, что данная величина приходится на 1 моль КОН, и это не очень большая величина. Для многих расчетов несколькими кДж/моль, а, следовательно, и концентрацией растворов можно пренебречь.
Пример 13
Пользуясь экспериментальными данными рассчитать стандартную энтальпию образования хлорид-иона.
Согласно Табл. 1 изменение энтальпии при растворении HCl составляет
HCl(г)=H+(р-р)+Cl-(р-р) D H°298, растворения = -75,1 кДж/моль
Применяя первое следствие из закона Гесса, и учитывая, что × D H°f,298 (Н+(р-р))=0, получаем
D H°298,растворения =D H°f,298 (Н+(р-р))+ D H°f,298 (Сl-(р-р))- D H°f,298 (НCl(г))
D H°f,298 (Сl-(р-р))= D H°298,растворения +D H°f,298 (НCl(г)) -D H°f,298 (Н+(р-р))=
= -75,1+ (-92,3)-0= -167,4 кДж/моль.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2951; Нарушение авторских прав?; Мы поможем в написании вашей работы!