
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Формирование навыков исследования равновесного распределения вещества между двумя несмешивающимися растворителями при постоянной температуре
|
|
|
|
Цель работы
Формирование навыков исследования равновесного распределения вещества между двумя несмешивающимися растворителями при постоянной температуре, расчета коэффициента распределения.
Если в систему из двух компонентов, содержащую две равновесные жидкие фазы, ввести небольшое количество третьего компонента, то после установления равновесия он окажется в обеих фазах, но в разном количестве. Если концентрация третьего компонента невелика и состояние его частиц в обеих фазах одинаково, то увеличение его количества в системе пропорционально увеличит его концентрации в обеих фазах.
Согласно закону распределения для каждой температуры отношение концентраций третьего компонента в двух равновесных жидких фазах при различных его концентрациях является величиной постоянной. Этот закон характеризует равновесное состояние системы и может быть представлен уравнением:
а1.1/а1.2= К, (14)
где а1.1 и а1.2 – активность растворенного вещества соответственно в растворителе 1 и 2.
Величину К называют коэффициентом распределения. Он зависит от природы компонентов, составляющих систему, и температуры. В разбавленных растворах вместо соотношения активностей для расчета коэффициента распределения можно пользоваться соотношением концентраций растворенного вещества в обеих фазах:
с1.1/с1.2= К, (15)
В ряде случаев распределяющееся вещество вследствие диссоциации или ассоциации его молекул обладает неодинаковым средним размером частиц в разных растворителях, и закон распределения может быть представлен уравнением:
К = с1.1/cn1.2, (16)
где n - показатель при постоянной температуре, независящий от концентрации и характеризующийся свойствами всех трех компонентов, составляющих систему. Он может быть выражен соотношением средних молярных масс распределяющегося вещества в первой и во второй фазах:
n = M1.1/M1/2. (17)
Отклонения от закона распределения наблюдаются при различных состояниях растворенных молекул в одной из фаз системы. Такими различными состояниями могут быть диссоциированные или ассоциированные молекулы растворенного вещества. По коэффициенту распределения можно определить степень диссоциации или ассоциации растворенного вещества в том или ином растворителе, константу равновесия реакции, протекающей в одной из фаз, активности растворенных веществ и другие свойства. Закон распределения широко используется при экстрагировании веществ из раствора.
Экстрагированием (экстракцией) называется извлечение вещества из раствора подходящим растворителем, которые не смешивается с первым и в то же время растворяет извлекаемое вещество в большем количестве, чем первый. Примем следующие обозначения:
g0 - начальное количество вещества, которое подвергается экстрагированию;
V1 – объем раствора, в котором находится экстрагируемое вещество;
V2 – Объем растворителя, при помощи которого производится одно экстрагирование;
n – общее число экстрагирований;
gn – количество вещества, остающееся в первоначальном растворе после n-го экстрагирования
К – коэффициент распределения экстрагируемого вещества.
После n экстрагирований в исходном растворе останется исходного вещества
gn = g0 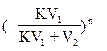 (17)
(17)
А всего будет извлечено вещества (g = g0 – gn):
G = g0 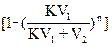 . (18)
. (18)
При экстракции коэффициентом распределения условились называть отношение концентрации раствора, из которого экстрагируется распределяющееся вещество, к концентрации раствора, которым производится экстрагирование.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 536; Нарушение авторских прав?; Мы поможем в написании вашей работы!