
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
III. Определение коэффициента распределения иода между органическим и неорганическим растворителями
|
|
|
|
Контрольные вопросы
5.1. Как влияет температура на константу равновесия? Что является мерой этого влияния? Напишите соответствующее уравнение.
5.2. Выразите в общем виде Кз для реакции:
СО + 2Н2  СН3ОН(газ),
СН3ОН(газ),
Если при данной температуре Т и давление Р равновесное количество моль метанола равно Х, а начальные количества компонентов, взятых для реакции, составляют 1 моль СО и 3 моль Н2.
5.3. Как изменится равновесный выход водорода по уравнению:
СН4 + 2Н2S  CS2 + 4H2
CS2 + 4H2
При повышении общего давления в системе, если все вещества находятся в идеальном газовом состоянии? Ответ мотивировать.
5.4. Напишите уравнение изотермы для реакции: Н2 + Br2  2HBr.
2HBr.
Все вещества находятся в идеальном газообразном состоянии.
5.5. Нарисуйте графики зависимости ln К от обратной температуры для экзотермической и эндотермической реакций.
5.6. Теплота образования (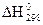 ) HCl5(тв) равна -463,5 кДж/моль.
) HCl5(тв) равна -463,5 кДж/моль.
Как нужно изменить давление и температуру, чтобы увеличить равновесный выход пентахлорида фосфора в реакции его образования?
5.7. Для каких реакций константа равновесия Кр равна равновесному давлению в системе при данной температуре? Приведите пример.
5.8. Для реакции N2 + O2  2NO зависимость константы равновесия от температуры выражается уравнением:
2NO зависимость константы равновесия от температуры выражается уравнением:
lgKp = - 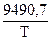 - 0,02 lgT + 1,43
- 0,02 lgT + 1,43
Выведите уравнение зависимости ΔН этой реакции от температуры.
5.9. В каком соотношении находятся величины Кр и Кс для реакции:
S2(тв) + 4Н2О  2SO2(газ) + 4Н2(газ)?
2SO2(газ) + 4Н2(газ)?
5.10. Напишите уравнение, связывающее стандартное сродство ΔG  и константу равновесия Кр при постоянных Р и Т, если давление выражено в паскалях.
и константу равновесия Кр при постоянных Р и Т, если давление выражено в паскалях.
5.11. Изменится ли и как значение константы равновесия Кр реакции
А + 2В  АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в идеальном газообразном состоянии.
АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в идеальном газообразном состоянии.
5.12. Зависимость константы равновесия реакции
2Cl2 + 2H2O(газ)  4НСl(газ) + О2
4НСl(газ) + О2
от температуры можно выразить уравнением: lg Kp = - 6007/T + 5,407. Выделяется или поглощается тепло в этой реакции?
5.13. Степень диссоциации HBr не зависит от давления, но в то же время увеличивается с ростом температуры. Объясните эти факты.
5.14. Сопоставьте равновесный выход продуктов двух реакций, протекающих в одинаковых условиях (Р, Т) в газовой фазе
А + В  АВ (1) и С + D
АВ (1) и С + D  CL (2), если ΔG1 > ΔG2.
CL (2), если ΔG1 > ΔG2.
5.15. Можно ли и в каких случаях по знаку изменения энтальпии в ходе химической реакции судить о возможности ее протекания при постоянных давлении и температуре?
5.16. Укажите, какие из факторов:
а) давление; б) температура; в) присутствие инертного газа; г) природа реагирующих веществ; д) парциальные давления взятых для реакции веществ- влияют на константу равновесия реакции Кр, если она протекает между веществами в идеальном газообразном состоянии.
5.17. Чему равна при 298 К константа равновесия реакции
2Ag(тв) + 1/2О2  Ag2O(тв)
Ag2O(тв)
если давление диссоциации Ag2O при этой температуре равно 5 . 10-9 Па?
5.18. Выразите в общем виде величину Кс для реакции
2SO 3  2SO2 + O2,
2SO2 + O2,
если диссоциации подвергаются n моль SO3. Общий объем равновесной смеси равен V, а степень диссоциации SO3 равна α.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1655; Нарушение авторских прав?; Мы поможем в написании вашей работы!