
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обработка результатов эксперимента
|
|
|
|
Порядок выполнения работы
Экспериментальная часть
3.1. Приборы и реактивы: колбы конические с притертыми пробками, колбы конические для титрования вместимостью 250 см3, пипетки Мора вместимостью 20см3, пипетки проградуированные вместимость 5,10 см3, резиновая груша, бюретки вместимость 25 см3; 0,05 н раствор J2 в органическом растворите; 0,01 н и 0,001 н растворы Na2S2O3; органические растворители: четыреххлористый углерод, хлороформ, бензол, толуол, ксилол, сероуглерод.
Приготовить в пронумерованных колбах с притертыми пробками вместимостью 250 см3 четыре смеси в соответствии с таблицей 6 (органический растворитель брать по указанию преподавателя).
Таблица 6
| N смеси | ||||
| Объем раствора J2 в органическом растворителе, см3 | ||||
| Объем органического растворителя, см3 | ||||
| Объем воды, см3 |
Колбы закрыть пробками и встряхивать 30 минут, затем оставить на 15 минут для расслоения. Для определения концентрации иода в водном слое пипеткой вместимостью 20 см3 три пробы из каждой колбы и титровать 0,001 н раствором Na2S2O3 в присутствии крахмала. Для определения концентрации иода в органическом слое необходимо градуированной пипеткой отобрать 2 см3 пробы, для чего закрыв пальцем внешнее отверстие пипетки, опустить ее через верхний слой в нижний. Не открывая верхнего отверстия пипетки, нагреть ее рукой и вытолкнуть каплю верхнего слоя. Затем с помощью груши взять пробу и внести ее в колбу для титрования, содержащую 25 см3 дистиллированной воды, и титровать 0,01 н раствором Na2S2O3 в присутствии крахмала.
При титровании органического слоя колбу для титрования необходимо сильно встряхивать, т.к. реакция протекает в водном слое после экстрагирования в него иода из органического соля. Результаты титрования занести в таблицу 7.
Таблица 7.
| N смеси | Водный слой | Неводный слой | |||||||||||
| Объем пробы см3 | Объем Na2S2O3 см3 | Концентрация иода С1 | Объем пробы см3 | Объем Na2S2O3 см3 | Концентрация иода С2 | n | K | Kcp | |||||
4.1. Рассчитать концентрацию иода в водном слое:
С1 =  .
.
По каждой колбе рассчитывают результаты 3 параллельных опытов, берется средний результат и заносится в таблицу.
4.2. Рассчитать концентрацию иода в неводном слое:
С2 = 
Расчет ведется аналогично водному слою, результаты заносятся в
таблицу 7.
4.3. Рассчитать значения С1, С2 по каждому опыту и построить график в координатах ln C1 = f(lnC2) в соответствии с уравнением:
lnK = n ln C2 – lnC1
ln C2 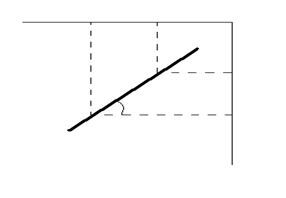 ln C2” ln C2’
ln C2” ln C2’
ln C1’
ln C1”
ln C1
4.4. Рассчитать показатель степени n в уравнении (19) по графику:
N = tg α = 
4.5. Рассчитать значение коэффициента распределения для четырех опытов: К = С 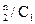
4.6. Рассчитать среднее значение коэффициента распределения:
Кср = (К1 + К2 + К3 + К4)/4.
4.7. Сформулировать выводы, сравнить полученный результат со справочными данными [7] и оформить отчет.
5. Контрольные вопросы
5.1. Каково термодинамическое условие самопроизвольного образования истинного раствора при постоянных Р и Т?
5.2. Что называется активностью компонента раствора?
5.3. Водный 0,02 М раствор пикриновой кислоты находится в равновесии с 0,07 М раствором пикриновой кислоты в бензоле. Вычислить коэффициент распределения пикриновой кислоты между бензолом и водой, если в бензольном растворе пикриновая кислота имеет нормальную молярную массу, а в воде частично диссоциирована, причем степень диссоциации равна α = 0,9
5.4. При распределении уксусной кислоты между тетрахлоридом углерода и водой были получены следующие концентрации (моль/л):
в тетрахлориде углерода……………3,63 7,25
в воде………………………………...54,20 76,40
Уксусная кислота в воде имеет нормальную молярную массу. Определить молярную массу уксусной кислоты в растворе ССl4 и коэффициент распределения.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!