
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи. 2 страница
|
|
|
|
Ответ: 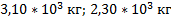
86. Рассчитайте парциальные давления при 350 0С и 1,20 МПа компонентов газовой смеси, приготовленной смешением С3Н6, NH3 и О2 в объемном отношении 25/3/6.
Ответ: р(С3Н6) = 8,76*105 Па, р(NH3) = 1,08*105 Па, р(О2) = 2,16*105 Па
87. Смесь газов С3Н6, NH3 и О2 поступает при 400 0С и 2,50 Мпа в реактор. Рассчитайте молярные концентрации ее компонентов на входе в реактор.
Ответ: (С3Н6) = 326 моль/м3, (NH3) = 40,2 моль/м3, (О2) = 80,4 моль/м3
88. При нитровании пропана получили газовую смесь следующего состава (в % (об.)): CH3N02 = 27,0 C2H3N02 = 11,0 C3H7N02 = 62,0. Какова плотность этой смеси при 300 0С и 1,3 МПа?
Ответ: 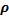 = 21,8 кг/м3
= 21,8 кг/м3
89. Газовую смесь следующего состава (в % (об.)): Н2 – 93,0; N2 – 5,0; Ar – 1,0 СН4 – 1,0необходимо смешать с азотом так, чтобы объемное отношение водорода с азотом в приготовленной смеси стало равным 2/1. Сколько азота потребуется для смешения со 100 м3 исходной смеси? Каким станет состав смеси после дополнения ее азотом? Давление и температуру газов принять постоянной.
Ответ: Н2 –65,7%,N2 –32,9% СН4 и Аr – по 0,7%
90. Определите парциальное давление этилбензола в смеси его с водяным паром на входе в реактор дегидрирования, если на 1 кг этилбензола в смеси приходится 2,6 кг воды, а температура воды 605 0С и давление 780 мм рт. ст.
Ответ: 6,38*103 Па
91. Смесь азота и водорода в объемном отношении 1/3 находится при 450 0С и 20МПа. Какова молярная концентрация компонентов этой смеси? Каким станет результат, если: а) повысить давление на 20 %; б) понизить давление в 2 раза; в) повысить температуру на 50 0С.
Ответ: с(N2) = 8,318*102 моль/м3,с(Н2) = 2,5*103 моль/м3
а) с(N2) = 1*103 моль/м3,с(Н2) = 3*103 моль/м3
б) с(N2) = 1,66*103 моль/м3,с(Н2) = 4,99*103 моль/м3
в) с(N2) = 7,8*102 моль/м3,с(Н2) = 2,3*103 моль/
92. Содержание аммиака в аммиачно-воздушной смеси, поступающей в контактный аппарат для окисления аммиака, составляет 11 %. Каковы парциальные давления аммиака и кислорода в этой смеси, если ее температура 160 0С, а давление 0,73 МПа? Содержание кислорода в воздухе принять равным 21%.
|
|
|
Ответ: 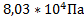 ;
; 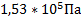
93. Рассчитайте парциальные давления и молярные концентрации компонентов газовой реакционной смеси состава (в % масс.) С6Н6,С3Н6,С3Н8 соответственно 47, 5; 15,8; и 36,7, если температура 3000С, давление 2,5*106 Па.
Ответ:  ;
; 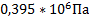 ;
; 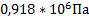 ;
; 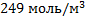 ;
; 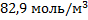 ;
; 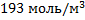
94. Определите плотность синтез газа состава (в % об.) СО,Н2,СО2, СН4 и N2 31,0; 51,5; 15,0;1,0; и 1,5 при 4000С и 3,00 МПа.
Ответ: 
95. Какова плотность реакционного газа при 300 0С и 1,30 МПа, если его плотность при стандартных условиях равна 2,153 кг/м3?
Ответ: 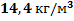
96. Определите плотность и концентрацию этилена при 270 0С и 5,00 МПа.
Ответ: 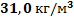

97. Плотность паров некоторого вещества при нормальных условиях равна 2,950 кг/м3. Какова молярная масса этого вещества?
Ответ: 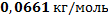
98. Пары 0,0240 кг вещества при 27 0С и 912 мм рт. ст. занимают пространство объемом 0,0250 м3. Какова молярная масса этого вещества?
Ответ: 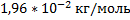
99. В емкости вместимостью 1500 м3 при - 25 0С и 4,00 атм содержится этилен. Определите его молярную массу. Каким станет давление газа в емкости, температуру повысить на 25 0С?
Ответ: 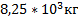 ,
, 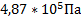
100. Установка пиролиза потребляет 1500 кг метана за 1ч. Выразите расход газа в (н)м3/ч. Какова концентрация метана в момент поступления его в реактор, если давление в аппарате 201 кПа, а температура 2100 К?
Ответ: 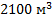 ,
, 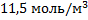
101. Этилбензол для производства стирола получают алкилированием бензола при 200 0С и 3,45 * 105 Па в присутствии BF3(катализатор) по реакции:  . Рассчитайте расход этилена для нормальной работы установки производительностью 40т/ч этилбензола, если на основную реакцию затрачивается 93 % от общего расхода.
. Рассчитайте расход этилена для нормальной работы установки производительностью 40т/ч этилбензола, если на основную реакцию затрачивается 93 % от общего расхода.
Ответ: 4,06 * 105 моль/ч, 9,74 * 103 (н)м3/ч.
102. Плотность воздуха при нормальных условиях равна 1,293 кг/м3. Какова его плотность при 25 0С и 742 мм рт. ст.?
Ответ: 
103. Какова плотность ацетилена при 65 0С и 12 МПа?
Ответ: 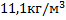
104. Плотность оксида углерода (II) при 800 0С равна 7,10 кг/м3. Определите концентрацию и давление газа.
|
|
|
Ответ: 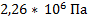 ;
; 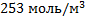
105. Плотность метана при 580 0С равна 3,2 кг/м3. Определите концентрацию газа и давление в аппарате.
Ответ: 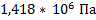 ;
; 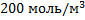
106. Плотнсть паров вещества Х при 25 0С и 70 мм рт. ст, равна 1,85 кг/м3. Какова молярная масса этого вещества?
Ответ: 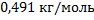
107. 2,00*10-4 кг вещества, испарившись при 22 0С и 405 мм. рт. ст., заняло объем 9,50*10-5 м3. Какова молярная масса этого вещества? Определите плотность его паров при 25 0С и 750 мм рт. ст.
Ответ:  ;
; 
108. Газообразный азот при нормальных условиях имеет плотность 1,25 г/л. Определите плотность этого газа при температуре 00С и давлении 5,065*105 Па.
Ответ: 
109. Для хлорирования питьевой воды хлор доставляется в баллонах под давлением. Можно ли считать хлор в этих условиях идеальным газом, если при температуре 0  давление в баллоне равно 3,722*105 Па, а при 30
давление в баллоне равно 3,722*105 Па, а при 30  - 15,47*105 Па?
- 15,47*105 Па?
Ответ: хлор при условиях задачи нельзя считать идеальным газом
110. При температуре 18 0С и давлении 98,64 кПа объем некоторого идеального газа равен 2 л. Приведите объем газа к нормальным условиям.
Ответ: 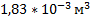
111. Определите массу карбоната кальция, необходимого для получения 12,3 м3 углекислого газа СО2, измеренного при температуре 180С и давлении 98600 Па.
Ответ: 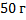
112. При н.у. 1 кг воздуха занимает объем 0,773 м3. Каков будет объем этого же количества воздуха при давлении 93280 Па и температуре 0  ?
?
Ответ: 
113. При 170С газ занимает объем 680 м3. Какой объем займет этот же газ при 100 0С, если давление его останется неизменным?
Ответ: 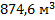
114. При 27 0С объем газа равен 16 м3. До какой температуры нужно нагреть газ при постоянном давлении, чтобы объем его увеличился до 20 м3?
Ответ: 
115. При 170С давление газа в закрытом сосуде 95940 Па. На сколько понизится давление, если охладить газ до -50 °С?
Ответ: 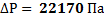
116. Стальной баллон наполнен азотом при температуре 18 °С и давлении 1,317* 10 Па. При какой температуре давление азота достигнет рабочего давления 1,52* 10 Па?
Ответ: 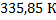
117. Какой объем занимает хлор массой 5 кг при нормальных условиях?
Ответ: 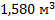
118. При температуре 17 °С и давлении 2*108 Па объем газа равен 350 см3. Какой объем займет этот газ при температуре -13 °С и давлении 933,1 гПа?
Ответ: 
119. Какой объем занимает 1 моль азота при температуре 57 °С и давлении 3,03*105Па?
Ответ: 
120. Определите объем, занимаемый углекислым газом массой 2 кг при температуре 10 0С и давлении 1,5* 105 Па.
|
|
|
Ответ: 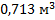
121. Какой объем займут 1*1023 молекул кислорода при температуре 17 °С и давлении 93,31 кПа?
Ответ: 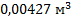
122. Определите массу кислорода, находящегося в колбе вместимостью 2 л при температуре 125 °С и давлении 93,31 кПа.
Ответ: 1,812 г
123. 1) При 10 °С и давлении 1 атм объем газа равен 1 л. Какой объем займет этот газ при той же температуре и давлении 2,5 атм? 2) При температуре 0  концентрация газа равна 3 моль/л. Под каким давлением находится газ?
концентрация газа равна 3 моль/л. Под каким давлением находится газ?
Ответ: 1) 0,0004 м3,2)6809,166 Па
124. Определите относительную молекулярную неизвестного вещесьва, если его пары массой 0,582 г при температуре 35 °С и давлении 100 кПа занимают объем, равный 200 мл.
Ответ: 
125. Масса 500 мл углеводорода СхНу, (х:у =1:1) в парообразном состоянии при температуре 90 °С и давлении 96 кПа равна 1,238 г. Определите молярную массу углеводорода и напишите его молекулярную формулу.
Ответ: 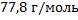
126. Под давлением 101325 Па при температуре 0 °С концентрация метана составляет 0,04472 кмоль/м3. Под каким давлением масса 4 м3 метана при 0 °С составит 32 кг?
Ответ: 
127. При 39 0С и 98740 Па масса 640 см3 газа равна 1,72 г. Вычислите молярную массу газа и его плотность при 20  .
.
Ответ: 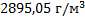
128. Масса 1 м3 сухого коксового газа при н.у. составляет 0,480 кг. Какова масса этого же объема газа под давлением 93300 Па при температуре 0 °С?
Ответ: 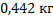
129. Масса 1 м3 сухого доменного газа при н. у 1,24 кг. Какова масса этого же объема газа при температуре 0  и давлении 1,566*105 Пa?
и давлении 1,566*105 Пa?
Ответ: 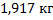
130. На сколько больше по массе может вместиться азота в газгольдере вместимостью 2000 м3 зимой (при температуре -35°С) по сравнению с летним периодом (при температуре 30 °С), если давление в нем равно
4*105 Па?
Ответ: 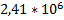 г
г
131. Колба содержит 5 молей идеального газа при температуре 25 0С и давлении 2 атм. Температуру газа повысили до 50 0С. Какая доля газа должна уйти из колбы, чтобы давление в ней осталось постоянным?
Ответ: 0,387 моль
132. При нормальных условиях плотность метана равна 0,7168 г/л. Какова будет плотность газа при температуре -10 °С?
Ответ: 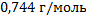
133. Плотность азота равна 1,251 кг/м3. Какое давление необходимо приложить, чтобы платность этого газа при 0°С составила 5 кг/м3?
|
|
|
Ответ: 
134. Плотность оксида углерода при 80 °С и нормальном давлении составляет 0,967 кг/м3 Определите плотность его при н.у.
Ответ: 
135. Вычислите плотность аммиака при температуре 18 °С и давлении 98,64 Пa.
Ответ: 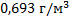
136. Определите объем, занимаемый смесью идеальных газов, состоящей из  кг газа с молярной массой
кг газа с молярной массой 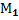 кг/маль и т2 кг газа с молярной массой
кг/маль и т2 кг газа с молярной массой 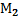 кг!моль. Температура смеси – Т К, давление - Р Па.
кг!моль. Температура смеси – Т К, давление - Р Па.
137. Сухой воздух имеет примерно следующий состав (в,% об)
N2 = 78,09; О2 = 20,95; Аr = 0,93; С02 - 0,03. Определите массу 40 м3 сухого воздуха при 22 0С и нормальном давлении.
Ответ: 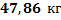
138. Генераторный газ имеет приблизительно следующий состав (в. %, об.): N2 = 54; Н2 = 14; СО = 20; С02 = 12.. Вычислите содержание каждой составной части генераторного газа в объемных долях (%).
Ответ: 
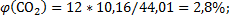
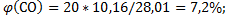
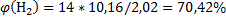 .
.
139. Смесь из кислорода массой 6,4 г, азота массой 14 г и некоторого количества углекислого газа при температуре 17 °С и давлении 202,6 кПа занимает объем равный 10 л. Вычислите массу углекислого газа и парциальное давление каждого из газов.
Ответ: 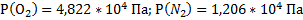 ;
; 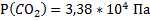
140. В баллоне вместимостью 20 л при температуре 18 0С находится смесь из 28 г кислорода и 24 г аммиака. Определите парциальное давление каждого из газов и общее давление смеси.
Ответ: 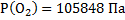 ;
;  ;
; 
141. Сосуд объемом 7 л содержит 0,4 г водорода и 3,15 г азота при 0 °С. Определите парциальные давления газов и общее давление газовой смеси.
Ответ: 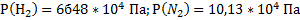 .
.
142. Смешаны кислород объемом 4 л под давлением 2*108 Па, азот объемом 6 л под давлением 5*105 Па и аммиак объемом 2 л под давлением 3* 105 Па. Объем смеси составил 10 л. Каковы парциальные давления газов и общее давление смеси?
Ответ: 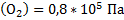 ;
;  ;
; 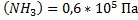 ;
; 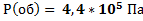
143. В состав сухого атмосферного воздуха входят (об. дали, %): азот - 78,04. кислород - 21, аргон – 0,93, углекислый газ - 0,03. Каково парциальное давление каждого из газов, если атмосферное давление равно 100 кПа?
Ответ: 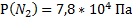 ;
; 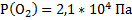 ;
; 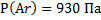 ;
; 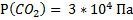
144. В сосуде вместимостью 5000 м3 при 47 °С содержится смесь из 10 кг азота, 1кг аммиака и 2 кг водорода. Вычислите парциальные объемы и давления газов, образующих смесь, и общее давление газовой смеси.
Ответ:  ;
; 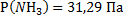 ;
;  ;
; 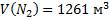 ;
; 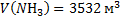 ;
; 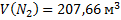
145. В сосуде объемом 4000 м3 при 27  находится смесь из З кг СО2, 1кг N2 и 9 кг СО. Вычислите парциальные объемы и давления газов, образующих смесь, и общее давление газовой смеси.
находится смесь из З кг СО2, 1кг N2 и 9 кг СО. Вычислите парциальные объемы и давления газов, образующих смесь, и общее давление газовой смеси.
Ответ: 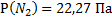 ;
; 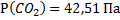 ;
;  ;
; 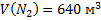 ;
; 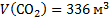 ;
; 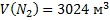
146. Смесь газов имеет состав (об. доли, %): Н2 - 3,0; СО2 - 11,0; СО - 26,0; N2 - 60,0. Определите мaccy 80 м3 этой смеси при температуре 15°С и нормальном атмосферном давлении.
Ответ: 
147. Средний состав сухого доменного газа (об. доли, %): СО - 28,0; Н2 -
148. 2,7; N2 - 58,5; СО2 - 10,5; СН4 - 0,3. Вычислите массу 10 г газа при 20 °С и 99950 Па.
Ответ: 
149. Сухой коксовый газ после улавливания из него химических продуктов имеет состав (об. доли. %): Н2 - 56,7; СО - 6,0: СО2 - 3; О2 - 0,8; СН4 - 26,0: N2 - 5,0; С2Н4 - 2,5. Вычислите массу 1 м3 коксового газа при 82 °С и 100500 Па. Каков состав коксового газа в массовых долях.
Ответ: 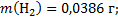
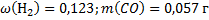 ;
; 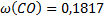 ;
; 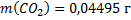 ;
; 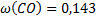 ;
;  ;
;  ;
; 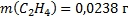 ;
;  ;
;  ;
; 
150. Пузырек газа с диаметром 1 см, находящийся у дна озера при температуре 5˚С и давлении 3 атм. поднимается на поверхность, где температура 25˚С и давление 1 атм. Какой будет диаметр пузырька, когда он достигает поверхности?(Присутствием в пузырьке водяного пара можно пренебречь.)
Ответ: 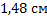
151. При определении молекулярного веса озона [1] получены следующие данные: температура 28,2˚С; вес колбы, наполненной озоном, 6,5998 г; вес эвакуированной колбы 6,7624 г; давление озона в колбе 274,4 мм рт. ст.; объем колбы 235, 67 см3.Вычислите молекулярный вес озона.
Ответ: 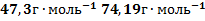
152. Вычислите давление (в атмосферах), создаваемое 2 молями пар хлорбензола занимающими объем 10 л при 250 С. Используйте: а) закон идеального газа; б) уравнение Ван - дер - Ваальса (а=25,43 л2 * атм. *моль-2, b=0,1453 л*моль-1).,
Ответ: а)  б)
б) 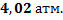
153. Смесь гелия и аргона весит 5г и занимает объем 10 л при 25  и 1 атм. Определите состав смеси в весовых процентах.
и 1 атм. Определите состав смеси в весовых процентах.
Ответ: 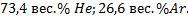
154. Плотность смеси СО и СО2 равна плотности О2. Определите объемные и массовые доли СО в смеси.
Ответ: хi=0,75; w = 66%
155. Смесь СО и СО2 имеет такую же массу, как и 1 моль воздуха, и занимает объём (н.у), равный объёму 28 г N2. Найдите массу и объем каждого газа в смеси.
Ответ: V(CO) = 21 дм 3; V (CO2)= 1,4 дм 3; m(CO) = 26,3 г
m (CO2) = 2,75 г
156. При каком мольном соотношении СО и СО2 получается смесь, которая в 2 раза тяжелее неона?
Ответ: n(CO)/n(CO2)=1/3
157. В каком объемном соотношении надо смешать Не и О2, чтобы плотность полученной смеси сравнялась с плотностью воздуха?
Ответ: V(He)= 2,4 дм3; V(O2)= 20 дм3
158. Газовая смесь, предназначенная для синтеза аммиака, имеет относительную плотность по водороду 8,8. Определите объёмные доли N2 и Н2 в смеси.
Ответ: 60% - N2 , 40% - H2
159. Какой должна быть массовая доля С2Н6 в его смеси с Н2, чтобы такая смесь была в 10 раз тяжелее водорода.
Ответ: 96,4%
160. Рассчитайте массовую долю водорода в его смеси с азотом, если известно, что эта смесь объёмом 4,48дм3 имеет массу, равную 3 г.
Ответ: 6,67%
161. При полном термическом разложении смеси AgNO3 и
Cu(NO3)2 образовалось газовая смесь (н.у) относительной плотностью по воздуху 1,4655. Определите массовые доли солей в исходной смеси.
Ответ: W AgNO  =0,475; W Cu(NO
=0,475; W Cu(NO  )
)  = 0,525.
= 0,525.
162. Газовая смесь (н.у) полученная при прокаливания до постоянной массы смеси CaCO3 и Cu(NO3)2 имеет относительную плотность по водороду 21,647. Определите массовые доли веществ в твердом остатке после прокаливания.
Ответ: w(CuO) = 81,9%
w(CaO) = 18,1 %
163. В результате полного термического разложения смеси KNO3 и Cu(NO3)2 выделилось 8,4 дм 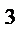 (н.у) смеси газов, в которой массовая доля элемента азота 14,302 %. Определите массу исходной смеси солей.
(н.у) смеси газов, в которой массовая доля элемента азота 14,302 %. Определите массу исходной смеси солей.
Ответ: 52,752 г.
164. Во сколько раз водород легче газовой смеси, в которой на каждые 10 атомов He приходится 5 атомов Ar?
Ответ: 8.
165. Объёмная доля неона в его смеси с аммиаком равна 10,0 %. Чему будет равна объёмная доля неона в смеси после разложения всего аммиака на простые вещества?
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 12144; Нарушение авторских прав?; Мы поможем в написании вашей работы!