
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи. 1.Температура газов окислительного пиролиза метана на выходе из зоны реакции 1450 0С
|
|
|
|
1. Температура газов окислительного пиролиза метана на выходе из зоны реакции 1450 0С. Определите расход воды на закалку этих газов в расчете на 1 (н) м3, если их температура при этом снижается до 80 0С, а температура воды повышается от 15 до 90 0С. Теплоемкость газов пиролиза принять равной 33,90 Дж/(моль*К), воды 4,183 Дж/(кг*К).
Ответ: 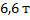
2. Этилен в производстве этиленоксида перед поступлением в реактор компримируется до 2,00 МПа. Какова потребляемая мощность компрессора производительностью 2000 кг/ч этилена, если исходное давление газа 0,150 МПа, исходная температура 20 0 С и компримирование протекает политропно с показателем политропы 1,34? Потерями энергии пренебречь.
Ответ: 
3. Температурная зависимость истинной молярной теплоемкости гематита Fe2O3 выражается уравнением Ср=103,58 + 67,21 *10-3Т - 17,74*105 Т-2 (кДж/(мольК)). Определите количество теплоты, необходимое для нагревания 1 кг гематита от 16 до 1538 °С.
Ответ: 1404,375 кДж
4. Рассчитайте изменение внутренней энергии при испарении 20 *10 -3 кг этилового спирта при нормальной температуре кипения, если его удельная теплота испарения 837,38 *103 Дж/кг, а удельный объем пара при этой температуре 607 * 10 -3 м3/кг. Объемом жидкости пренебречь.
Ответ: 
5. В резервуаре вместимостью 5*10-2 м3 при 200 К и 0,5*105 Па содержится азот. Определите теплоту, которую необходимо передать газу, чтобы его давление стало 2*105 Па. Считать азот в указанных условиях идеальным газом. Необходимые для решения данные возьмите из справочника.
Ответ: 
6. Рассчитайте изменение энтальпии при нагревании 2 кг a-Si02 от 298 до 800 К, если зависимость теплоемкости от температуры выражается уравнением Cp = 46,94 + 34,31*10-3 T - 11,3*105/T2.
Ответ: 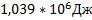
7. Удельная теплота испарения воды при 1000С и давлении 1 атм равна 2255 Дж/г. Вычислить работу испарения одного моля воды при указанных условиях, а также найти изменение внутренней энергии ∆U и энтальпии ∆ Н для процесса испарения.
Ответ: Таким образом, теплота, затраченная на испарение воды преимущественно идет на увеличение внутренней энергии пара по сравнению с производимой работой.
8. Определите работу 3 моль испарения метанола при нормальной температуре кипения.
Ответ: А = 7,9475 кДж
9. У олова имеются две аллотропические модификации: серое и белое олово. Плотность серого и белого олова равна соответственно 5,75 и 7,28 г/см3. Какую работу производит эта система по отношению к окружающей среде, когда 1 моль белого олова превращается в серое олово при 130С и давлении 1 атм.
Ответ: 0,44 кДж/моль
10. Рассчитать работу, которая совершается при растворении 15г магния в растворе НСl: а) в закрытом сосуде; б) в открытом стакане. Растворение происходит при температуре 300К.
Ответ: а) A = 0,б) A = 1558,9 Дж/моль
11. 1 моль СаСО3 нагрет до 880 оС, при этом он разлагается. Разложение происхдит в контейнере, закрытом поршне, который вначале соприкасался с образцом и прижимался к нему атмосферным давлением. Какая работа совершается над окружающей атмосферой при полном разложении СаСО3? Изменение энтальпии в результате протекания реакции при этих условиях  r H = 169,90 кДж/моль. Чему равно изменение внутренней энергии?
r H = 169,90 кДж/моль. Чему равно изменение внутренней энергии?
Ответ: A = 9587,289 кДж/моль;  U = 160312 Дж/моль
U = 160312 Дж/моль
12. Удельная теплота испарения этанола при температуре его кипения78,40С и давлении 1 атм. равна 840 Дж/г. Вычислить работу испарения одного моля этанола при этих условиях, а также найти увеличение внутренней энергии и энтальпии этанола при испарении.
Ответ: Ар = 2922,79 Дж/моль;Q = 38649 Дж/моль;  H испарения = 41562,79 Дж/моль
H испарения = 41562,79 Дж/моль
13. В термически изолированной комнате объемом 27 м3 находиться воздух, теплоемкость которого Ср = 29 Дж/моль*К. В комнате имеется небольшая щель, через которую воздух может просачиваться наружу, где давление 1 атм. Сколько тепла необходимо для нагревания комнаты от 00С до 200С, если теплоемкость воздуха считать постоянной?
Ответ: 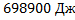
14. При определении энтальпии сгорания нафталина (C10H8) в кислороде в калориметрической бомбе найдено, что при сгорании 1,1226 г нафталина температура калориметрической системы возросла на 4,0630°С. Повышение температуры исправлено с учетом энтальпии сгорания запальной проволочки и образования сажи, окиси углерода и азотной кислоты. Теплоемкость калориметрической системы 2660 кал; молеку лярный вес нафталина 128,11 г*моль-1. Определите энтальпию сгорания 1 моля нафталина при 18°С. Ответ: 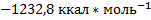
15. Калорическая ценность пищевых продуктов (фактически энтальпия сгорания единицы массы пищевых продуктов) может быть определена измерением теплоты, выделяющейся при горении взвешенного образца пищи при условии постоянства объема в калориметрической бомбе. Выделяющееся тепло при полном сгорании 1 г (3*10-3 моля) куриного жира в этих условиях (постоянный объем) составляет 10 ккал при 37° С. Определите калорическую ценность куриного жира (кал*г-1) при 37° С и постоянном давлении, т. е. стандартную теплоту сгорания куриного жира при 37° С. Реакция может быть представлена уравнением С20Н32О2 (тв) + 27О2 (г) → 20СО2 (г) + 16Н2О (ж). Ответ: 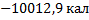
16. Определите энтальпию плавления льда (кал*моль-1) при —10°С из следующих данных: Ср(Н2О, тв) = 9 кал*моль-1-°К-1; Cр (H2О, ж) = 18 кал*моль-1*0К-1; ∆Н плавления льда при 0°С 1435 кал*моль-1.
Ответ: 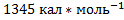
17. Для реакции 2А2(тв) + 5В2(г) = 2A2B5(г) ∆U298 = 15 000 кал. Определите ∆Н298 для этой реакции.
Ответ: 13222 кал.
18. Стандартная энтальпия сгорания ∆Н0298 твердого нафталина (С10Н8) равна -1231,6 ккал*моль-1. Продукты сгорания — СО2 и жидкая вода. Найдите стандартную энтальпию образования нафталина при 25° С.
Ответ: 17,8 ккал*моль-1.
19. Температурная зависимость истинной молярной теплоемкости кристобалита  SiO2 выражается уравнением Ср = 71,61 + 1,9*10 -3Т -37,59* 105Т-2 (Дж/(моль*К)). Определите количество теплоты, необходимое для нагревания 1 кг кристобалита от 16 до 1538 °С.
SiO2 выражается уравнением Ср = 71,61 + 1,9*10 -3Т -37,59* 105Т-2 (Дж/(моль*К)). Определите количество теплоты, необходимое для нагревания 1 кг кристобалита от 16 до 1538 °С.
Ответ: 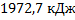
20. Изопропиловый спирт получают прямой гидратацией пропилена по реакции: С3Н6 (г.) + Н20 (г.) —> (СН3)2 СНОН (г.) в присутствии поливольфрамовой кислоты. Определите расход энергии на ведение процесса, если производительность установки 1400 кг/ч изопропилового спирта.
Ответ: 337 кВт
21. При получении синтез - газа из гексана основная реакция идет по уравнению: С6Н14(г.) + 302 (г.)  6СО (г.) + 7Н2 (г.). Пренебрегая побочными явлениями, определите тепловой режим процесса, если он протекает при I860 0С в реакторе производительностью 2,50 т/ч синтез-газа состава СО/Н2 = 6/7 (по объему).
6СО (г.) + 7Н2 (г.). Пренебрегая побочными явлениями, определите тепловой режим процесса, если он протекает при I860 0С в реакторе производительностью 2,50 т/ч синтез-газа состава СО/Н2 = 6/7 (по объему).
Ответ: 1876 кВт
22. Температура реактора синтеза винилхлорида поддерживается равной 200 0С за счет теплоотвода охлаждающим маслом. Определите расход масла на 1 кг продукта, если при образовании 1 кг винилхлорида выделяется 112,4 кДж теплоты, температура масла при прохождении через рубашку реактора повышается от 20 до 180 0С, а его теплоемкость равна 2,60 кДж/(кг*К).
Ответ: 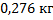
23. Обжиг известняка проводится при 1100 0С. Определите расход теплоты на обогрев сырья до температуры процесса, если он состоит в основном из СаСО3 и поступает в печь обжига при 20 0С.
Ответ: 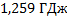
24. Температура газов пиролиза на выходе из зоны реакции (плазмотрона) равна 1600 0С. Определите необходимый расход на закалку (быстрое охлаждение) этих газов в расчете на 1 кг их, если их теплоемкость равна 4,15 кДж/(кг*К), температура на выходе из зоны закалки 150 0С, а температура воды на входе в аппарат 20 0С и на выходе 100 0С. Теплоемкость воды принять равной 4,18 кДж/(кг*К).
Ответ: 
25. В теплообменнике, питаемой водой, при нормальном давлении конденсируются пары этанола. Определите расход воды, если производительность аппарата 350 кг/ч этанола, температура воды на входе в аппарат 15 0С, на выходе из него 35 0С, а температура выходящего из пара этанола 53 0С. Теплоемкость воды принять равной 4,184 кДж/(кг*К). Нормальная температура кипения этанола 78 0С. Нормальная теплота испарения этанола Q = 42,18 кДж/моль.
Ответ: 
26. В целях утилизации энергии теплоту отходящих газов собирают регенератора – камерах, наполненных теплоаккумулирующим материалом (теплоноситель). Сколько энергии может аккумулировать 1м3 камеры такого регенератора при повышении температуры ее теплоносителя от 150 до 1500 0С, если теплоносителем служит: а) огнеупорный кирпич (с = 1,26 кДж/(кг*К); 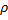 = 2560 кг/м3; б) магнетит (с = 0,88 кДж/(кг*К);
= 2560 кг/м3; б) магнетит (с = 0,88 кДж/(кг*К); 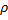 = 5000 кг/м3;в) корунд (с = 0,36 кДж/(кг*К);
= 5000 кг/м3;в) корунд (с = 0,36 кДж/(кг*К); 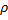 = 4000 кг/м3;а) кварц (с = 1,07 кДж/(кг*К);
= 4000 кг/м3;а) кварц (с = 1,07 кДж/(кг*К); 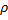 = 2650 кг/м3.
= 2650 кг/м3.
Ответ: a)  ;б)
;б)  ;в)
;в) 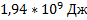 ;г)
;г) 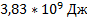
27. В производстве этиленоксида, при использовании воздуха вместо чистого кислорода, состав циркулирующей смеси на входе в реактор следующий: С2Н4 – 20,0; О2 – 7,0; СО2 – 5,0; N2 – 68,0. (в % об.). Рассчитайте расход теплоты на предварительный подогрев реакционной смеси от 40 до 280 0С, если расход смеси в реактор равен 2400 кг/ч.
Ответ: 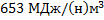
28. Состав коксового газа (в % об.).) N2 – 7,0; СO2 – 2,0; Н2 – 57,0; СО – 6,0 и СН4 – 28,0. Сколько теплоты «приносит» 1 (н) м3 этого газа в котел – утилизатор, если в нем этот газ остывает от 700 до 200 0С? Потерями пренебречь.
Ответ: 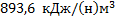
29. Определите тепловой эффект разбавления 30,8%-ного водного раствора NaOH до концентрации 0,442% при 298 К.
Ответ: 

30. Нитрозные газы производства азотной кислоты поступают в котел – утилизатор при 900 0С, где за счет их остывания до 300 0С образуется водяной пар. Определите теплоту, поставляемую 1(н) м3 нитрозных газов на производство пара, если их состав следующий (в% об.) N2 – 76,0;O2 – 14,0; NO – 10,0.
Ответ: 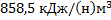
31. Определите теплоту растворения (q) KCl массой 2 г в 100 г воды по интегральным теплотам растворения KCl при 298 К.
Ответ: 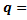

32. Вычислите теплоту образования 1 моля твердого раствора KBr*KCl из индивидуальных веществ при 298 К. Состав твердого раствора: 8 моль KCl на 1 моль KBr. Теплота растворения 2 г твердого раствора в 100 мл воды 460 Дж, а теплота растворения механической смеси в 100 мл воды 466 Дж.
Ответ: 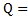
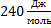
33. Коэффициент сжимаемости 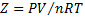 для С02 при 0
для С02 при 0  и 100 атм. равен 0,2007. Вычислите объем 0,1 моля газа при 100 атм. и 0°С. Используйте: а) закон идеального газа; б) коэффициент сжимаемости.
и 100 атм. равен 0,2007. Вычислите объем 0,1 моля газа при 100 атм. и 0°С. Используйте: а) закон идеального газа; б) коэффициент сжимаемости.
Ответ: а) 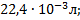 б)
б) 
34. Коэффициент сжимаемости 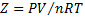 для азота N2 при -50
для азота N2 при -50  и 800 атм. равен 1,95; при 100
и 800 атм. равен 1,95; при 100  и 200 атм. 1,10. Объем некоторого количества азота при -50
и 200 атм. 1,10. Объем некоторого количества азота при -50  и 800 атм. равен 1 л. Вычислите объем того же количества азота при 100
и 800 атм. равен 1 л. Вычислите объем того же количества азота при 100  и 200 атм.
и 200 атм.
Ответ: 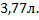
35. Найдите  при 1000° К для реакции 02(г)
при 1000° К для реакции 02(г) 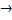 20 (г),
20 (г), 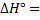 117,04 ккал; СР(0) =
117,04 ккал; СР(0) = 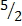 R.
R.
Ответ: 118,58 ккал
36. Найдите  и
и 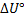 при 25° С для реакции H2S (г)+
при 25° С для реакции H2S (г)+  O2 (г)
O2 (г) 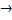 Н20 (г) + SO2 (г).б) Найдите
Н20 (г) + SO2 (г).б) Найдите  Н° при 1000° К. в) Имеете ли Вы достаточное количество сведений для того, чтобы найти
Н° при 1000° К. в) Имеете ли Вы достаточное количество сведений для того, чтобы найти 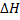 ° при 2000
° при 2000  К? Объясните.
К? Объясните.
Ответ: а) 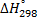 = - 123,94 ккал;
= - 123,94 ккал;  - 123,64 ккал;б)
- 123,64 ккал;б)  = -122,58ккал.
= -122,58ккал.
37. Найдите  при 1000° К для реакции 02(г)
при 1000° К для реакции 02(г) 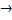 20 (г),
20 (г), 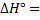 117,04 ккал; СР(0) =
117,04 ккал; СР(0) = 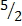 R.
R.
Ответ: 118,58 ккал
38. Выведите уравнение зависимости  от температуры для приведенной ниже реакции. (Конечное уравнение должно содержать только Т и числа.)
от температуры для приведенной ниже реакции. (Конечное уравнение должно содержать только Т и числа.)
А(тв) + 2В2(г)  А В4 (г)
А В4 (г)  300= 500 ккал
300= 500 ккал
СР(А, тв) = 5 + 3  10-3T (кал
10-3T (кал  моль-1
моль-1  °К-1).
°К-1).
СР(В2, г)=6 + 4  10-3Т (кал
10-3Т (кал  моль-1
моль-1  °К-1)
°К-1)
СР(АВ4, г) =7 + 5  10-3Г (кал
10-3Г (кал  моль-1
моль-1  °К-1)
°К-1)
Ответ: 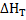 = 500000 - 10∙ (Т - 300) --
= 500000 - 10∙ (Т - 300) --  ∙6∙I0-3(Т2 - 3002) = 503270 – 10Т - 3∙10-3Т2.
∙6∙I0-3(Т2 - 3002) = 503270 – 10Т - 3∙10-3Т2.
39. Для гипотетической реакции 2А(г) 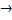 А2(г)
А2(г)  СР= 1 + 2
СР= 1 + 2  10-3 кал
10-3 кал  °К-1и
°К-1и  298=-5 ккал. Определите для этой реакции температуру, при которой
298=-5 ккал. Определите для этой реакции температуру, при которой  = 0 при постоянном давлении.
= 0 при постоянном давлении.
Ответ: 1880° К
40. Рассчитайте  процесса разбавления 5 мл насыщенного раствора LiCl в 200 мл воды при 298 К, если суммарная теплоемкость калориметрической системы А = 1248 Дж/град.
процесса разбавления 5 мл насыщенного раствора LiCl в 200 мл воды при 298 К, если суммарная теплоемкость калориметрической системы А = 1248 Дж/град.
Ответ: 
41. Вычислите среднюю теплоемкость аммиака  в интервале температур от 298 до 1000 К.
в интервале температур от 298 до 1000 К.
Ответ: 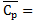

42. Вычислите изменение энтальпии при нагревании AgCl от 298 до 1000 К при стандартном давлении ( ) и полную энтальпию AgCl при 1000 К. При 728 К происходит плавление AgCl,
) и полную энтальпию AgCl при 1000 К. При 728 К происходит плавление AgCl, 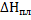 при температуре плавления 13,21 кДж/моль. Зависимость теплоемкости AgClтв от температуры возьмите в справочнике. Теплоемкость жидкого AgCl в интервале от 728 до 1000 К остается практически постоянной и равной 66,99 Дж/(моль*К).
при температуре плавления 13,21 кДж/моль. Зависимость теплоемкости AgClтв от температуры возьмите в справочнике. Теплоемкость жидкого AgCl в интервале от 728 до 1000 К остается практически постоянной и равной 66,99 Дж/(моль*К).
Ответ: 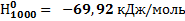
43. В калориметр смешения, теплоемкость которого равна 13,2 кал/град, поместили 400 г 0,3%-ного раствора Н202 и добавили небольшое количество М.п02. После окончания реакции температура повысилась на 1,97 °С. Вычислите, сколько теплоты выделяется при разложении одного моля пероксида водорода. (Удельная теплоемкость раствора с=1 кал/(г-град)).
Ответ: 23,1 (ккал/моль)
44. Калориметр, используемый для определения тепловых эффектов реакций, представляет собой ячейку, которая погружена в сосуд, содержащий 3000 г воды. Температуру измеряют с помощью чувствительного термометра, резервуар которого находится в воде. Теплоемкость калориметра равна 1672Дж/град. В ячейку калориметра поместили 4,6 г глицерина. При его полном сгорании в избытке 02 температура воды в сосуде калориметра поднялась на 5,85 "С. Вычислите, сколько теплоты выделяется при сгорании одного моля глицерина. (Удельная теплоемкость воды сНгО = 4180 Дж/(кг * град).)
Ответ: 1663 (кДж/моль)
45. При сжигании 2,3 г этилового спирта в калориметрической бомбе, помещенной в калориметр с водой, температура воды повысилась на 5,72 °С. Измерения проводили при 25 °С. Суммарная теплоемкость воды и калориметрической бомбы равна 12 кДж/град. Вычислите: а) молярную теплоту сгорания этилового спирта при постоянном объеме; б) молярную теплоту сгорания этилового спирта при постоянном давлении (вода и спирт находятся в жидком состоянии; газы считайте идеальными).
Ответ: а) 1373 (кДж/моль);б) 1375 (кДж/моль)
46. Коксовый газ имеет следующий объемный состав: 60 % Н2, 7 % СО, 1 % N2, 25 % СН4; 7 % С02. При сжигании одного моля Н2, СН4 и СО выделяется 58, 213 и 69 ккaл соответственно Вычислите, сколько теплоты выделится при сжигании 1 м3 коксового газа (объем указан в пересчете на нормальные условия).
Ответ: 4160 (ккал)
47. Теплота образования Н20 (г.) при стандартных условиях (25 °С, 1 атм) равна 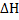 = -57,8 ккал/моль. Удельная теплоемкость Н20 (г.) зависит от температуры следующим образом: с = 0,373 + 5*10-5 t (кал/(г*град)); t - температура (°С). Рассчитайте максимальную температуру, которая может быть достигнута при горении стехиометрической смеси Н2 и 02, если все выделяющееся тепло расходуется на нагревание паров воды. Изменится ли максимальная температура при сжигании Н2 в воздухе, содержащем столько кислорода, сколько его требуется по уравнению реакции?
= -57,8 ккал/моль. Удельная теплоемкость Н20 (г.) зависит от температуры следующим образом: с = 0,373 + 5*10-5 t (кал/(г*град)); t - температура (°С). Рассчитайте максимальную температуру, которая может быть достигнута при горении стехиометрической смеси Н2 и 02, если все выделяющееся тепло расходуется на нагревание паров воды. Изменится ли максимальная температура при сжигании Н2 в воздухе, содержащем столько кислорода, сколько его требуется по уравнению реакции?
48. При 25°С и 1 атм изменение внутренней энергии системы ( U) в результате реакции Н2(г.) + 1/2 02 (г.) = Н20 (ж.) равно —282,1 кДж/моль. В интервале температур от 25 до 100°С средние молярные теплоемкости Н2 (г.), 02 (г.) и Н20 (ж.) равны 28,9; 29,4 и 75,5 Дж/(моль*град) соответственно. Вычислите изменение энтальпии реакции образования воды из Н2 (г.) и 02 (г.) при 100 °С и 1 атм. Ответ: -283,4 (кДж/моль).
U) в результате реакции Н2(г.) + 1/2 02 (г.) = Н20 (ж.) равно —282,1 кДж/моль. В интервале температур от 25 до 100°С средние молярные теплоемкости Н2 (г.), 02 (г.) и Н20 (ж.) равны 28,9; 29,4 и 75,5 Дж/(моль*град) соответственно. Вычислите изменение энтальпии реакции образования воды из Н2 (г.) и 02 (г.) при 100 °С и 1 атм. Ответ: -283,4 (кДж/моль).
49. Степень сжатия двигателя Дизеля равна 18 ( . Рассчитайте температуру и давление в цилиндре такого двигателя в конце сжатия, если начальная температура воздуха в цилиндре 100 0С и давление 0,10 МПа. Процесс считать идеальным адиабатическим.
. Рассчитайте температуру и давление в цилиндре такого двигателя в конце сжатия, если начальная температура воздуха в цилиндре 100 0С и давление 0,10 МПа. Процесс считать идеальным адиабатическим.
Ответ: 
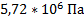
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 5934; Нарушение авторских прав?; Мы поможем в написании вашей работы!