
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При нормальном давлении газу путем нагревания сообщено 2,093 кДж теплоты. Определите изменение внутренней энергии газа, если он при этом расширился от 0,01 до 0,02 м3. 2 страница
|
|
|
|
 ,
, 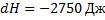
Процесс С:  ,
,  ,
, 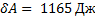
Для цикла:  ,
, 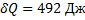 ,
, 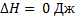 ,
, 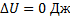
131. 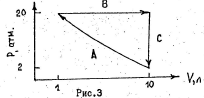 Один моль одноатомного идеального газа обратимо совершает цикл, состоящий из трех процессов (рис.3)
Один моль одноатомного идеального газа обратимо совершает цикл, состоящий из трех процессов (рис.3)
Процесс А – изотермическое сжатие
газа; процесс В – изобарное расширение газа; С – изохорное охлаждение газа.
Рассчитать теплоту, работу, изменение внутренней энергии и энтальпии для каждого процесса и для цикла в целом.
Ответ: Процесс А: А = 0,Q = A = - 4666 Дж, 
 ,
,  ,
, 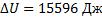
Процесс С: 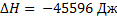 ,
, 
Для цикла:  ,
, 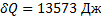 ,
, 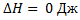 ,
, 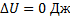
132. 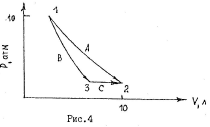 Один моль двухатомного газа из 1 в состояние 2 может перейти либо изотермически (кривая А на рис.4) при Т = 300К, либо сперва адиабатически (кривая В), а затем изобарический (кривая С). Предполагая, что процессы А, В и С обратимы, рассчитать давление и температуру газа в состоянии 3. Найти работу и теплоту процесса А, а также работу и теплоту суммарного процесса В и С.
Один моль двухатомного газа из 1 в состояние 2 может перейти либо изотермически (кривая А на рис.4) при Т = 300К, либо сперва адиабатически (кривая В), а затем изобарический (кривая С). Предполагая, что процессы А, В и С обратимы, рассчитать давление и температуру газа в состоянии 3. Найти работу и теплоту процесса А, а также работу и теплоту суммарного процесса В и С.
Ответ:  P3 = 249420Па = 2,46 атм Процесс А:
P3 = 249420Па = 2,46 атм Процесс А: 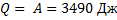 Cуммарная работа процессов В и С: 2879,4 Дж
Cуммарная работа процессов В и С: 2879,4 Дж
133.  Один моль одноатомного идеального газа из состояния 1 переходит в состояние 2, далее в состояние 3 и снова возвращается в исходное состояние 1 (рис.5). Рассчитать теплоту, работу, изменение внутренней энергии и энтальпии каждой стадии цикла и всего цикла, предполагая что все стадии цикла обратимы.
Один моль одноатомного идеального газа из состояния 1 переходит в состояние 2, далее в состояние 3 и снова возвращается в исходное состояние 1 (рис.5). Рассчитать теплоту, работу, изменение внутренней энергии и энтальпии каждой стадии цикла и всего цикла, предполагая что все стадии цикла обратимы.
Ответ: Процесс А: А = 0,Q = 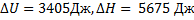
 ,
, 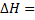
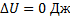
Процесс С: 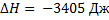 ,
,  , A = -2270 Дж
, A = -2270 Дж
Для цикла:  ,
, 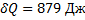 ,
, 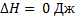 ,
, 
134. Двуокись углерода в количестве 100 г находится при 0 0С и давлении 1,013 * 105 Па. Определите Q, A,  U и
U и  H: а) при изотермическом расширении до объема 0,2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления 2,026 * 105 Па; г) при адиабатическом сжатии до 2,026 * 105 Па.Принять, СО2 подчиняется законам идеальных газов, и истинна мольная теплоемкость СО2 при постоянном давлении постоянна и равна 37,1 Дж/(моль*град).
H: а) при изотермическом расширении до объема 0,2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления 2,026 * 105 Па; г) при адиабатическом сжатии до 2,026 * 105 Па.Принять, СО2 подчиняется законам идеальных газов, и истинна мольная теплоемкость СО2 при постоянном давлении постоянна и равна 37,1 Дж/(моль*град).
Ответ: а)  б)
б) 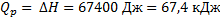 ;
;  ;
; 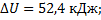 в)
в)  ;
;  г)
г)  ;
; 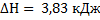
135. Один моль идеального газа расширяется обратимо и изотермически от давления 1 атм до 10 атм при температуре 300 К. Найти теплоту и работу процесса. Чему равно изменение внутренней энергии и энтальпии для указанного процесса? Ответ: Q = 5743 Дж.
136. Один моль одноатомного идеального газа находится при температуре 300 К и давлении 5 атм. В результате адиабатического расширения давление газа уменьшилось и стало равным 1 атм. Рассчитать конечную температуру газа, работу и теплоту процесса, если:а) расширение протекало обратимо;б) расширение протекало необратимо против постоянного внешнего давления 1 атм.
Ответ: 1. В процессе адиабатического расширения газа происходит его охлаждение. Это явление широко используется в холодильной технике для ожижения газов.
2. Работа обратимого адиабатического расширения больше, чем необратимого, хотя конечное давление газа в обоих случаях одинаковое.
137. Горение фосфора можно выразить уравнением: 2Р + 2,502 = Р205. Представьте этот процесс термохимическим уравнением, если известно, что при сгорании фосфора массой 1 г выделяется 24,7 кДж теплоты.
Ответ: 2Р + 2,502 = Р205 + 1530 кДж
138. Теплота сгорания этилового спирта С2Н5ОН равна 1367,7 кДж/моль. Определите теплоту образования этилового спирта, если при горении образуются углекислый газ и вода в жидком состоянии.
Ответ: 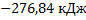 /моль
/моль
139. Определите теплоту полного сгорания нитробензола, если его теплота образования равна 15,9 кДж.
Ответ: 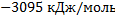
140. Вычислите тепловой эффект реакции при 25 °С:
СаС2(тв) + 2Н2О (ж) = Са (OH)2(та) + C2H2(г). Ответ: -127 кДж/моль
141. Определите тепловой эффект основного процесса доменной печи:
Fе2О3 + ЗСО = 2Fе + ЗС02. Ответ: - 26,8 кДж/моль
142. Определите теплоту сгорания фосфина 2РН3 + 402 =Р2О5 + 3Н20 используя следующие термохимические уравнения:
2Р + ЗН2 = 2РН3 - 48,69 кДж
2Р + 5/202 = Р205 + 1508,4 кДж
Н2 + 1/202 = Н2О(ж) + 285 кДж. Ответ: 1157 кДж
143. Определите теплоту сгорания этилового спирта
С2Н5ОН + 302 = 2СО2+ ЗН20(ж)
исходя из следующих данных:
С + О2 = СО2 + 394 кДж.
Н2 + 1/202 =Н20(ж) + 285 кДж.
2С + ЗН2 + 1/202 = С2Н5ОН + 278,2 кДж. Ответ: 
144. Определите теплоту образования сероуглерода, используя следующие термохимические уравнения:
S + О2 = SO2 + 297,5 кДж,
CS2 + 302 = СО2 + 2SO2 + 1109,9 кДж,
С + О2 = С02 + 394,0 кДж. Ответ: 
145. Определите, какое количество теплоты выделится при взаимодействии 30 кг оксида фосфора (V) с водой P205 + H2О = 2HP03 + Q, если известны тепловые эффекты реакций:
2Р +5/202 = Р205 + 1508,4 кДж.
Н2 +1/202 = Н20(ж) + 285 кДж.
2Р + Н2 + 302 = 2НРО3 +1912,3 кДж. Ответ: 25120 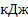
146. Определите количество теплоты, выделяющейся при гашении 500 кг извести водой, если
Са + 1/202 = СаО + 636,9 кДж
Са + 02 + Н2 = Са(ОН)2 + 988,0 кДж
Н2 + 1/202 = Н20 + 285 кДж. Ответ: 5,9 * 105 кДж
147. Определите теплоты образования веществ при постоянном объеме и температуре 25  , если известны энтальпии для следующих реакций:
, если известны энтальпии для следующих реакций:
а) Н2 + 1/202 = Н20 г, 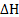 = - 242 кДж;
= - 242 кДж;
б)1/2N2 + 3/2Н2 = NH3, 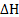 = -46,2 кДж;
= -46,2 кДж;
в)1/2Н2 + I/2F2 = HF, 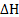 = -268,8 кДж;
= -268,8 кДж;
г)1/2N2 + 02 = N02, 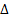 Н = 33,87 кДж.
Н = 33,87 кДж.
Ответ: а) 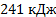 б)
б)  в)
в)  г)
г) 
148. При горении в стандартных условиях водорода массой 2 г в кислороде с образованием жидкой воды выделяется 286 кДж. Чему равен тепловой эффект реакции при постоянном объеме? Ответ: 
149. Вычислите тепловой эффект реакции при 25 °С при постоянном давлении и при постоянном объеме. Реакции выражаются уравнениями:
SO2 +Cl2 = SO2Cl2(г);
СО + С12 = С0С12(г);
СН4 + СО2 = 2СО + 2Н2
Ответ: а) 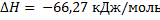 ;
; 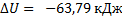 ;б)
;б) 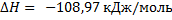 ;
;  ;в)
;в) 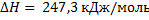 ;
; 
150. Определите теплоту образования оксида меди (II), зная, что при восстановлении 1 моля оксида меди (II) углем с образованием оксида углерода (II) поглощается 44,74 кДж тепла. Ответ: 
151. Вычислите тепловой эффект при постоянном давлении и постоянном объеме при 250С для реакции, которая выражается уравнением:
С02 + Н2 = СО + Н20(ж). Ответ:  ;
; 
152. Определите тепловой эффект реакции ЗС2Н2 = С6Н6 в стандартных условиях, если теплоты сгорания ацетилена 1300 кДж/моль, а жидкого бензола равна 3270 кДж/моль.
Ответ: 
153. Вычислите теплоту образования ацетилена из простых веществ в стандартных условиях: 2С + Н2 = С2Н2. Теплоты сгорания твердого углерода, водорода и ацетилена соответственно равны 393,8 кДж/моль, 286 кДж/моль и 1300 кДж/моль. Ответ:  кДж/моль
кДж/моль
154. Тепловой эффект сгорания нафталина до диоксида углерода и воды (в жидком состоянии) при постоянном объеме и 18 0С равен 5162 кДж/моль. Определите тепловой эффект сгорания нафталина при постоянном давлении и той же температуре. Ответ: 
155. Воспользовавшись таблицей стандартных значений энтальпий, вычислите Qv для реакций:
2H2S + 02 = 2Н2О + 2S + Qv;
NH3 + HCl = NH4Cl + Qv.
Ответ:  ;
; 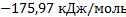
156. Вычислите стандартную теплоту реакции дегидрирования этана 2С2Н6 = 2СН4 + С2Н2 + Н2 проводимой в газовой фазе. Теплоты сгорания этана, метана, ацетилена и водорода (кДж/ моль) соответственно равны 1560; 890,2; 1299,0; 285,9.
Ответ: 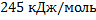
157. Вычислите теплоту образования бензола 6С+ЗН2=С6Н6 + Q если теплоты сгорания водорода, углерода и бензола соответственно равны (кДж /моль) 285,0; 394,0; 3282,4 Ответ: 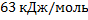
158. Вычислите тепловые эффекты следующих реакций используя табличные (справочные) величины энтальпий образования веществ при стандартных условиях:
С2Н4 + 2Н2Ож = 2СО + 4Н2 + Q,
Fе304 + Н2 = 3FеO + Н2Ож + Q;
Ответ:  ;
; 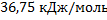
159. Определите стандартную теплоту реакции получения 1,3-бутадиена из этанола, протекающей в газовой фазе (25 °С): 2С2Н5ОН = C4H6 + Н2 + 3H2Oпар. В расчете воспользуйтесь справочными величинами энтальпий образования участвующих в реакции веществ.
Ответ: 
160. Один из методов получения ацетилена - окислительный пиролиз метана (неполное горение в кислороде): 11СН4 + 702 = 2С2Н2 + 14Н2 + СО2 + 6Н20 + 6СО. (Все вещества в газообразном состоянии.) Вычислите стандартную теплоту реакции, воспользовавшись справочными величинами энтальпий образования участвующих в реакции веществ. Ответ: 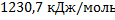
161. Воспользовавшись таблицей стандартных значений энтальпий образования веществ, вычислите тепловой эффект реакции нитрования бензола: С6Н6 г + HNO3 ж =С6Н5NO2 + Н20(ж).
Ответ: 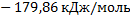
162. Определите, какое количество теплоты потребуется для образования 100 г уксусноэтилового эфира по реакции: С2Н5ОН + СН3ОООН = СН3СООС2Н5 + Н20, если теплоты сгорания этилового спирта, уксусной кислоты и уксусноэтилового эфира соответственно равны 1374; 871,6 и 2256 кДж/моль. Ответ: 11,8 кДж/моль
163. Разложение гремучей ртути происходит согласно уравнению: Hg(CNO)2 = Hg + 2СО + N2 + 364,2 кДж/моль. Определите объем выделяющихся газов при н.у. и количество теплоты при взрыве 1кг Hg(CNO)2. Ответ: 1279 кДж; 0,2361 м3
164. Определите теплоту растворения соли MgS04*7H20, если теплота растворения безводной соли при 18 °С равна 85 кДж/моль, а теплота гидратации этой соли равна 101,1 кДж/моль. Ответ: 
165. Теплота растворения соли NH4N03, равна -26,8 кДж/моль. Определите, как и на сколько градусов Цельсия изменится температура при растворении соли массой 20 г в воде массой 180 г. Удельная теплоемкость полученного раствора равна 3,77 Дж/(г*К). Ответ: 10 оС
166. Как изменится теплота сгорания акролеина при смене изобарического режима процесса на изохорический? Ответ:  Дж/моль.
Дж/моль.
167. Определите тепловой эффект реакции
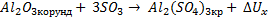
Если реакция протекает при 298 К в автоклаве при постоянном объеме, а тепловой эффект реакции при Р = const равен 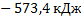 .
.
Ответ: 
168. Определите тепловой эффект реакции образования ацетальдегида из гликоля при 298 К и стандартном давлении по уравнению

Ответ: 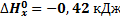
169. Вычислите тепловой эффект образования аммиака из простых веществ при стандартном давлении и температуре 298 К по тепловым эффектам реакций:
 (1)
(1)
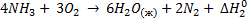 (2)
(2)
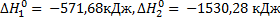
Ответ: 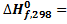
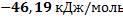
170. Известны энтальпии реакции (1) и (2) при температуре 273 К и постоянном давлении 101,3 кПа. Рассчитайте при тех же условиях энтальпию реакции (3).
С + 02 = С0 2, 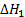 = - 405,8 кДж
= - 405,8 кДж
H2 + ½ O2: = H2O (г) 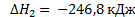
С + 2 H2O (г)  = С02 + 2 H2
= С02 + 2 H2  = х. Ответ:
= х. Ответ: 
171. Определите энтальпию реакции Аl2O3 (корунд)+ 3SO3= Al2(SO4)3 (кр)
в стандартных условиях при Т = 298 К. Ответ: 
172. Используя стандартные энтальпии сгорания соединений, вычислите энтальпию реакции при температуре 298 К С2Н5ОН(ж) + СН3COOН (ж) = СН3СООС3Н6(ж)+ Н2О(ж) Ответ: 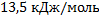
173. Используя следующие термохимические уравнения вычислите энтальпии образования Na20 (тв.), NaOH(aq) и Na2C03 (тв.) из простых веществ:
Н2 (г.) + 1/202 (г.) = Н20 (ж.) + 242 кДж (1)
Na (тв.) + Н20 (ж.) + aq = NaOH (aq) + 1/2Н2 (г.) + 231кДж (2)
Na20 (тв.) + Н20 (ж.) + aq = 2NaOH (aq) + 282 кДж (3)
С (тв.) + 02 (г.) = С02 (г.) + 400 кДж (4)
Na20 (тв.) + С02 (г.) = Na2C03 (тв.) + 320 кДж (5)
Ответ: - 1142 кДж/моль
174. Даны следующие термохимические уравнения:
FeS2 (тв.) = FeS (тв.) + S (тв.)  = 51,83 кДж
= 51,83 кДж
S (тв.) = S (г.)  = 65,2 кДж
= 65,2 кДж
S (г.) + 02 (г.) = S02 (г.)  =-361,57 кДж
=-361,57 кДж
4FeS(tb.)+702(г.)=2Fe203(tb.)+4S02(г.) 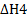 = -2492,2 кДж
= -2492,2 кДж
Вычислите: а) энтальпию окисления одного моля пирита; б) энтальпию образования SO2 по реакции S (тв.) + 02 (г.) => S02 (г.); в) состав газовой смеси, полученной при обжиге 4 моль пирита в 1232 л воздуха (воздух содержит 20% (по объему) кислорода; объем воздуха указан в пересчете на нормальные условия).
Ответ: а) - 867,6 (кДж/моль FeS2);б) —296,37 (кДж/моль SO2);в) фSO2= 15,4%;фN2 = 84,6%
175. Даны следующие термохимические уравнения:
2С2Н2 (г.) + 502 (г.) = 4С02 (г.) + 2Н,0 (г.)  = -2510 кДж
= -2510 кДж
С2Н4(г.) + 302(г.) = 2С02(г.) +2Н20(г.) 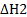 =-1322 кДж
=-1322 кДж
2Н2 (г.) + О2 (г.) = 2Н20 (г.)  = -484 кДж
= -484 кДж
Вычислите Энтальпию реакции гидрирования ацетилена с образованием этилена. Ответ: - 175 (кДж/моль)
176. Зная энтальпии следующих процессов вычислите среднюю энергию связи С-Н в метане:
С (алмаз) + 2Н2 (г.) = СН4 (г.)  = —18 ккал/моль (1)
= —18 ккал/моль (1)
С (графит) = С (алмаз) 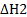 = —124,2 ккал/моль (2)
= —124,2 ккал/моль (2)
2Н (г.) = Н2 (г.)  = -103,3 ккал/моль Н2 (3)
= -103,3 ккал/моль Н2 (3)
Ответ: 87,2 ккал/моль
177. Даны термохимические уравнения: С2Н4(г.) +Н2(г.) = С2Н6 (г.)  = - 137 кДж/моль; С2Н2 (г.) + 2Н2 (г.) = С2Н6(г.)
= - 137 кДж/моль; С2Н2 (г.) + 2Н2 (г.) = С2Н6(г.)  = - 311 кДж/моль и энергии связей С—Н, С—С и Н—Н: 414, 337 и 429,5 кДж/моль соответственно. Вычислите: а) энергию двойной связи С=С; б) энергию тройной связи С
= - 311 кДж/моль и энергии связей С—Н, С—С и Н—Н: 414, 337 и 429,5 кДж/моль соответственно. Вычислите: а) энергию двойной связи С=С; б) энергию тройной связи С  С. Ответ: 823 кДж/моль
С. Ответ: 823 кДж/моль
178. Оцените стандартную энтальпию образования карбида вольфрама WC(тв) на основе следующих данных:
С (графит) + О2(г) → СО2(г) ∆Н0298 = -94,052 ккал
WC(тв) + 5/2О2 (г) → WО3 (тв) + СО2(г) ∆Н0298= -285,80
W(тв) + 3/2О2 (г) → WО3 (тв) ∆Н0298= -200,16
Ответ: 
179. Стандартная энтальпия сгорания борогидрида алюминия Аl(ВН4)3(ж) равна -989,1 «кал-моль-1 при 298,2° К. А1(ВН4)3 (ж) + 6О2(г) → ½ Аl2О3 (крист. корунд) + 3/2 В2О3 (крист) + 6Н2О(ж). Вычислите стандартную энтальпию образования А1(ВН4)3 (г). Энтальпия испарения Аl(ВН4)3 (ж) 7,2 ккал*моль-1, а энтальпии образования необходимых для расчета соединений равны: А12О3 (крист. корунд) -399,09 ккал*моль-1; В2О3 (крист) -303 ккал-моль-1. Ответ: 
180. При 298,2° С стандартная энтальпия образования Mg(NО3)2 составляет -188770 кал-моль-1, стандартная энтальпия растворения -21 530 кал*моль-1,а стандартная энтальпия образования иона NO3- -49320 кал*(г-ион)-1 [15]. Вычислите стандартную энтальпию образования нона Mg2+ при этой температуре. Ответ: -111,660 ккал*(г-ион-1)
181. Стандартная энтальпия сгорания жидкого пиридина при 298,15° К равна -664,95 ккал*моль-1 [16]. Определите стандартную энтальпию образования пиридина при 298,15° К. Ответ: +23,90 ккал*моль-1
182. Энтальпия образования безводного хлорида магния ( Н) равна -632 кДж/моль. Теплота растворения (Q2) одного моля Mg в разбавленной хлороводородной кислоте (разбавление бесконечное) равна 453 кДж/моль. Тепловой эффект образования (Q3) бесконечно разбавленного раствора НС1 из простых веществ (Н2 С12) и воды равен 165 кДж/моль. На основании приведенных данных вычислите теплоту растворения MgCl2 при бесконечном разбавлении.
Н) равна -632 кДж/моль. Теплота растворения (Q2) одного моля Mg в разбавленной хлороводородной кислоте (разбавление бесконечное) равна 453 кДж/моль. Тепловой эффект образования (Q3) бесконечно разбавленного раствора НС1 из простых веществ (Н2 С12) и воды равен 165 кДж/моль. На основании приведенных данных вычислите теплоту растворения MgCl2 при бесконечном разбавлении.
Ответ: 151 кДж/моль
183. Вычислите по энергиям химических связей стандартную энтальпию образования диэтилового эфира при температуре 298 К в газообразном состоянии. Энтальпия возгонки углерода 523 кДж/моль. Энергии связей: Н – Н (431,9), О = О (493,8), С – Н( 357,98), С – С( 262,30), С – О( 314,0). Ответ:  (кДж/моль).
(кДж/моль).
184. Определите тепловой эффект химической реакции при 500 К

Теплоемкости всех веществ, участвующих в химической реакции, постоянные и равны 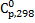 . Ответ:
. Ответ: 
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 5708; Нарушение авторских прав?; Мы поможем в написании вашей работы!