
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При нормальном давлении газу путем нагревания сообщено 2,093 кДж теплоты. Определите изменение внутренней энергии газа, если он при этом расширился от 0,01 до 0,02 м3. 3 страница
|
|
|
|
185. Определите тепловой эффект химической реакции при 500 К

при 500 К и стандартном давлении. При расчете воспользуйтесь средними теплоемкостями веществ в интервале температур от 298 до 500 К.
Ответ:  = 13,365 Дж/(моль*К),
= 13,365 Дж/(моль*К), 

186. Выразите уравнением зависимости теплового эффекта химической реакции 
от температуры, которое справедливо для интервала 298 до 1000 К.
Ответ: 
187. Определите тепловой эффект реакции SO2 + Cl2 = SO2Cl2 при 800 К и стандартном давлении. Ответ: 
188. Рассчитайте разность (  Н0 —
Н0 —  U°) при 1,0133*105 Па в следующих процессах: Н2 + 1/202 = Н20 (при 298 К) (а)
U°) при 1,0133*105 Па в следующих процессах: Н2 + 1/202 = Н20 (при 298 К) (а)
СН3С00С2Н5 + Н20 = СН3С00Н+С2Н50Н (при 298 К) (б)
l/2N2 + 3/2H2 = NH3 (при 673 К) (в)
С + 2Н2 = СН4 (при 1073 К) (г)
Ответ:  б)
б)  в)
в)  г)
г) 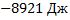
189. Определите тепловой эффект реакции при постоянном давлении и объеме, если известны теплоты сгорания веществ
СН=СН + С0 + Н20 (ж) =СН2=СНСООН (ж)
Вещество...... СН=СН СО Н20(ж) СН2=СНСООН(ж)
 ,кДж/моль.. —1299,63 —283,18 0 - 1368,03
,кДж/моль.. —1299,63 —283,18 0 - 1368,03
Ответ:  кДж/моль,
кДж/моль, 
190. Рассчитайте теплоты образования метана из простых веществ при 298 К и стандартном давлении и при V = const на основании следующих данных: для Н20 (ж)  кДж/моль; для C02
кДж/моль; для C02  393,51 кДж/моль; теплота сгорания СН4
393,51 кДж/моль; теплота сгорания СН4  кДж/моль. Ответ:
кДж/моль. Ответ: 
191. Теплота образования Fe203 из простых веществ равна при 298 К и стандартном давлении — 821,32 кДж/моль, а А1203 = 1675,60 кДж/моль. Рассчитайте тепловой эффект реакции восстановления 1 моль Fe203 металлическим алюминием.
Ответ: 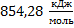
192. Вычислите тепловые эффекты следующих реакций при 298 К и стандартном давлении:
(СООН)2 (тв) = НСООН (ж) + С02 (а)
С2Н5ОН (ж) + 02 = СН3С00Н (ж) +Н2О (ж) (б)
2СН3С1 (г) + Mg (тв) = С2Н6 (г) +MgСl2 (в)
ЗС2Н2 (г) = С6Н6 (ж) (г)
CH4 + 4S02Cl2 (ж) = СС14 (ж) + 4S02 + 4HCl (д)
Ответ: а)  ; б)
; б)  в)
в)  г)
г)  д)
д)  .
.
193. При сгорании нафталина в калориметрической бомбе при 298 К с образованием воды и диоксида углерода тепловой эффект равен — 5152,96 кДж/моль. Вычислите теплоту сгорания нафталина при постоянном давлении, если водяной пар, образующийся при сгорании нафталина: а) конденсируется; б) не конденсируется.
Ответ: а) 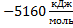 б)
б) 
194. Определите теплоту образования кристаллической аминоуксусной кислоты NH2CH2COOH при 298 К и стандартном давлении на основании ее теплоты сгорания, равной — 976,72 кДж/моль.
Ответ: 
195. Определите тепловой эффект реакции S02 + С12 = S02С12 (ж) при 340 К, если принять, что теплоемкости всех реагирующих веществ не зависят от температуры и равны теплоемкостям при 298 К. Значения
Ответ: 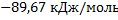
196. Энтальпии образования СН4 (г.), С02 (г.) и Н20 (г.) в стандартных условиях равны —78, —395 и —242 кДж/моль соответственно. Рассчитайте: а) теплотворную способность метана, выраженную в МДж/м3; б) количество теплоты, которое выделится при полном сгорании 20 м3 метана, взятого при 25 °С и давлении 1 атм. (При расчетах следует считать, что вода образуется в парообразном состоянии.) Ответ: 32,8 (МДж/м3); 656 (МДж)
197. В стандартных условиях (25°С, 1 атм) теплоты сгорания щавелевой кислоты до Н20 (ж.) и С02 (г.), графита до С02 (г.), водорода (г.) до Н20 (ж.) равны 252, 395 и 286 кДж/моль соответственно. Рассчитайте стандартную энтальпию образования щавелевой кислоты.
Ответ: - 824 кДж/моль
198. Теплоты сгорания ацетилена и ацетальдегида в стандартных условиях (25°С, 1 атм) равны 1308 и 1171 кДж/моль соответственно. Вычислите энтальпию гидратации ацетилена по реакции Кучерова в стандартных условиях. Ответ: - 137 кДж/моль
199. Энтальпии образования С2Н5ОН (г.), С02 (г.) и Н20 (г.) в стандартных условиях равны —235, —393 и —242 кДж/моль соответственно. Рассчитайте энтальпию сгорания одного моля паров этилового спирта (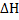 ). Вычислите энтальпию этого же процесса, используя значения энергий связей (кДж/моль): Ес-с = 262; Ес-н = 358; Ес=о = 730; Ео=о = 491; Ео-н = 460; Ес-о = 314. Сравните полученную величину с величиной, рассчитанной на основе энтальпий образования в стандартных условиях. Ответ: а) - 1277 кДж/моль;б) - 1381 кДж/моль
). Вычислите энтальпию этого же процесса, используя значения энергий связей (кДж/моль): Ес-с = 262; Ес-н = 358; Ес=о = 730; Ео=о = 491; Ео-н = 460; Ес-о = 314. Сравните полученную величину с величиной, рассчитанной на основе энтальпий образования в стандартных условиях. Ответ: а) - 1277 кДж/моль;б) - 1381 кДж/моль
200. Энергия химической связи О-Н в воде и спиртах одинакова. Было также показано, что энергия химической связи С-О одинакова в спиртах и простых эфирах. Что можно сказать на основе этих данных об энтальпии реакции образования простых эфиров из спиртов? Проверьте, справедливо ли ваше предположение для реакции образования простого эфира из метилового спирта, если известны следующие значения  Н:
Н:
 Нобр (СН3ОН (ж.)) = —238,7 кДж/моль
Нобр (СН3ОН (ж.)) = —238,7 кДж/моль
 Нобр (Н20(ж.)) = — 285,8 кДж/моль
Нобр (Н20(ж.)) = — 285,8 кДж/моль
 Н обр (СН3—О—СН3 (г.)) = —185,4 кДж/моль
Н обр (СН3—О—СН3 (г.)) = —185,4 кДж/моль
Ответ: 6,2 (кДж/моль эфира)
201. Для реакции CH3OH(г)+ 3/2О2= СО2 +2Н2О(г) определите зависимость энтальпии реакции от температуры. Рассчитайте значение энтальпии реакции в стандартных условиях и при температуре 500 К.
Ответ: 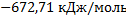
202. При 298,16° К стандартная энтальпия сгорания цис- гексагидроиндана (цис- С9Н16)равна — 1351, 60 ккал*моль-1. Процесс сгорания может быть представлен уравнением:
цис- С9Н16(ж)+ 13 О2(г) → 9СО2(г)+8Н2О (ж).
а) Вычислите стандартную энтальпию образования 1 моля цис -гексагидроиндана из простых веществ при 298,16° К
б) Какой будет ответ, если за стандартное состояние углерода принят алмаз вместо графита?
С(алмаз) → С(графит) ∆Н0298 = -0,45 ккал.
Ответ: а)  ; б)-0,45 ккал
; б)-0,45 ккал
203. Для вычисления теплоты растворения 1 моль НС1 (г.) в n моль воды используют следующую эмпирическую формулу:

Тепловой эффект (Q) образования разбавленного раствора (разбавление бесконечное) из простых веществ (Н2 и С12) и воды равен 165 кДж/моль. Вычислите: а) энтальпию образования НС1 (г.); б) количество теплоты, выделяющееся при растворении 224 л НС1 (г.) в 1,8 л воды (объем НС1 указан в пересчете на нормальные условия).
Ответ: а) - 92,4 кДж/моль; б) 676 кДж
204. Определите тепловой режим реактора синтеза акрилонитрила, если процесс в нем описывается уравнением: С2Н2 (г.) + HCN (г.)  CH2 = CHCN (ж.), а производительность реактора равна 800 кг/ч акрилонитрила. Рассчитайте расход воды на охлаждение этого реактора, если она подается в аппарат при 18 °С и отводится от него при 82 °С. Теплоемкость воды принять равной 4180 Дж/(кг*К).
CH2 = CHCN (ж.), а производительность реактора равна 800 кг/ч акрилонитрила. Рассчитайте расход воды на охлаждение этого реактора, если она подается в аппарат при 18 °С и отводится от него при 82 °С. Теплоемкость воды принять равной 4180 Дж/(кг*К).
Ответ: Расход воды на охлаждение составляет 9,80 * 103 кг/ч.
205. При обжиге 0,860 г пирита, содержащего FeS2, С и неокисляющуюся пустую породу, в 2,5 л воздуха получили твердую смесь, содержащую Fe203, Fe304 и пустую породу, а также 2,4283 л газовой смеси следующего состава: 6,46 % С02, 3,25 % 02 7,93 % S02 и 82,36 % N2 (проценты по объему; объемы газов даны в пересчете на нормальные условия). Термохимические уравнения реакций окисления приведены ниже:
4FeS2 + 1102 = 2Fe2O3 + 8SO2,  = —3407 кДж (1)
= —3407 кДж (1)
3FeS2 + 802 = Fe304 + 6S02 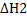 = — 2433 кДж (2)
= — 2433 кДж (2)
С + 02 = С02  = — 395 кДж (3)
= — 395 кДж (3)
Вычислите: а) процентный состав пирита; б) количество теплоты, которое выделится при обжиге 100 кг пирита в тех же условиях. (При расчетах примите, что воздух содержит 20 % 02 и 80 % N2 (по объему).)
Ответ: а) 0,5159 г FeS2, 0,0841 г С и 0,860 — 0,5159 — 0,0841 = 0,260 г пустой породы. Массовые доли компонентов исходного образца составляют 60 % FeS2, 9,8 % С, 30,2 %;б)747*103 кДж пустой породы.
206. а) При растворении 1,6 г CuS04 в 144,9 г Н20 выделяется 665 Дж, а при растворении 1,25 г CuS04*5H20 в 72 г Н20 поглощается 59,65 Дж. Вычислите энтальпию образования кристаллогидрата сульфата меди из CuS04 (тв.) и Н20 (ж.).
б) Можно ли рассчитать энтальпию этого процесса, если будут известны теплота растворения 3,2 г CuS04 в 144 г воды и теплота растворения 2,5 г CuS04*5H20 в 54 г воды? Мотивируйте свой ответ.
Ответ: а)  Н = - Q3= - 78,43 кДж/моль; б) нельзя вычислить
Н = - Q3= - 78,43 кДж/моль; б) нельзя вычислить  Н образования кристаллогидрата.
Н образования кристаллогидрата.
СПИСОК ЛИТЕРАТУРЫ
1) Ахметов, Б.В. Задачи и упражнения по физической и коллоидной химии/ Б.В. Ахметов. – Ленинград: Химия, 1988. – 240с.
2) БГУ
3) Будруджак, П. Задачи по химии: Перевод с румынского канд. хим. наук С.В. Калугера; под ред. С.С. Чуранова – Москва: Мир, 1989. – 343с.
4) Врублевский, А.И. Тренажер по химии/ А.И. Врублевский. – 4-е изд., перераб. и доп. – Минск: Красико-Принт, 2010. – 656с.
5) Картушинская, А. И., Лельчук, X. А., Стромберг, А. Г. Сборник задач по химической термодинамике. Под ред. А. Г. Стромберга. Учеб. пособие для химико-технологических вузов. М., «Высш. школа», 1973. – 224 с илл.
6) Кудряшов, И.В. Сборник примеров и задач по физической химии: Учеб. пособие для хим.-технол. спец. вузов./ И.В Кудряшов, Г.С. Каретников – 6-е изд., перераб. и доп.– Москва: Высшая школа, 1991. – 527с.
7) Лабовиц, Л., Дж. Аренс. Задачи по физической химии с решениями: Перевод с английского канд. хим. наук В.П. Вендилло; под ред. проф. Ю.В. Филиппов. – Москва: Мир, 1972. – 443с.
8) Слышенков, В.С., Бурдь, Г.А, Минюк, Г.Е. Агрегатные состояния вещества. Химическая термодинамика: пособие. – Гродно: ГрГу, 2008. – 137 с.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2413; Нарушение авторских прав?; Мы поможем в написании вашей работы!