
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 2. Первый закон термодинамики
|
|
|
|
Первый закон термодинамики устанавливает взаимосвязь между внутренней энергией системы U, сообщаемой системе теплотой Q и совершаемой системой работой А:
 .
.
Внутренняя энергия системы - это сумма всех видов энергии движения и взаимодействия частиц, составляющих систему (молекул, атомов, электронов, атомных ядер). Внутренняя энергия U зависит только от физического состояния системы и не зависит от способа или пути, которыми система приведена в это состояние, т.е. внутренняя энергия U - функция состояния системы. Внутренняя энергия - экстенсивное свойство.
Работа. совершаемая системой обусловлена взаимодействием системы с внешней средой, в результате которого преодолеваются внешние силы, нарушившие равновесие в системе. Работа не является функцией состояния системы: величина совершаемой системой работы зависит от характера процесса, в результате которого система переходит из начального состояния 1 в конечное состояние 2. Т. о. работа А - функция процесса. т.е. зависит от того, каким способом система перешла из данного начального состояния 1 в конечное состояние 2.
Теплота - форма передачи энергии путем теплообмена между телами с различной температурой, т.е. при взаимодействии системы с внешней средой. Более нагретое тело отдаст часть теплоты менее нагретому телу. Теплота Q, как и работа, является функцией процесса.
Чтобы подчеркнуть это различие, математическое уравнение первого закона термодинамики приводят в дифференциальной форме, соответствующей бесконечно малому изменению состояния системы:
 Q = dU +
Q = dU +  A, или
A, или  Q = dU + pdV+
Q = dU + pdV+  A'.
A'.
Эти уравнения представляют собой математическое выражение первого закона термодинамики для закрытых систем. Если единственным видом работы, совершаемой системой, является работа расширения, то
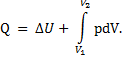
В случае изолированных систем, когда обмен энергией х!сжду системой и окружающей средой отсутствует, первый закон термодинамики примет вид:dU = 0, или U = const.
Для открытых систем необходимо учесть обмен системы с окружающей средой веществом, поэтому 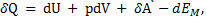
где dEM - изменение внутренней энергии системы, связанное с изменением количества вещества в ней.
1. Изотермический процесс (Т = const). При совершении этого процесса внутренняя энергия системы не меняется, и вся сообщаемая ей теплота расходуется на работу по расширению
системы: U=const => dU = 0,
 .
.
Для п молей идеального газа
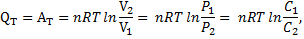
где T - температура, при которой протекает процесс (K): V1 и V2 - начальный и конечный объем системы (м3); Р1 и Р2 - начальное и конечное давление в системе (Па); С1 и С2 - начальная и конечная концентрация газа в системе (моль/м3), QT, АТ и 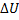 - теплота, работа и изменение внутренней энергии системы соответственно (Дж).
- теплота, работа и изменение внутренней энергии системы соответственно (Дж).
2. Изохорный (изохорический) процесс протекает при постоянном объеме (V=const, 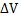 =0), поэтому работа системой не совершается, а вся теплота, подведенная к системе, идет на увеличение ее внутренней энергии.
=0), поэтому работа системой не совершается, а вся теплота, подведенная к системе, идет на увеличение ее внутренней энергии.
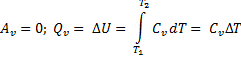
Для п молей идеального газа:

где T1 иT2 - начальная и конечная температура системы (K); 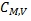 - молярная изохорная теплоемкость (Дж/(моль*К)).
- молярная изохорная теплоемкость (Дж/(моль*К)).
3. Изобарный (изобарический) процесс протекает при постоянном давлении (р = const), поэтому теплота, подведенная к системе, идет на увеличение ее внутренней энергии и на совершение системой работы, то есть, на изменение энтальпии системы  Н:
Н:
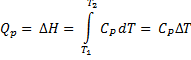
Для п молей идеального газа:
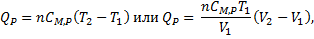
Работа при изобарическом процессе равна:

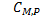 - молярная изобарная теплоемкость (Дж/(моль*К)).
- молярная изобарная теплоемкость (Дж/(моль*К)).
4. При адиабатном (адиабатическом) процессе теплообмен между системой и окружающей средой отсутствует (QA=0), поэтому работа системой может совершаться только за счет убыли ее внутренней энергии:
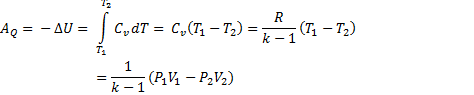
Для п молей идеального газа работа в этом случае может быть вычислена по уравнениям:
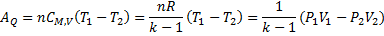
где к - показатель адиабаты (коэффициент Пуассона):

Давление, объем и температура в начале и конце адиабатного процесса связаны уравнением адиабаты:
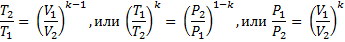
После логарифмирования последнего уравнения:
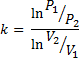
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1092; Нарушение авторских прав?; Мы поможем в написании вашей работы!