
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия. Закон Гесса
|
|
|
|
Раздел физической химии, изучающий тепловые изменения при химических реакциях, называется термохимией.
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается в процессе, протекающем необратимо при условии, что объем или давление в системе постоянны, не совершается никакой работы, кроме работы расширения, а температура исходных веществ и продуктов реакции одинакова.
Тепловые эффекты, отнесенные к стандартным условиям (25 °С (298,15 К). 101325 Па) называют стандартными тепловыми эффектами. В качестве стандартного состояния для простых веществ принимают устойчивое фазовое и химическое состояние элемента при данной температуре.
Для расчета тепловых эффектов химических реакций используют термохимические уравнения, в которых указываются агрегатные состояния участвующих в реакции веществ, полиморфная модификация (для твердых веществ), тепловой эффект или изменение энтальпии реакции, рассчитанные для стандартных условий.
В термохимии, в отличие от термодинамики принята следующая система знаков: теплота считается положительной, если она выделяется в окружающую среду, т.е. если энтальпия системы уменьшается (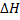 < 0 или
< 0 или  U< 0). Поэтому
U< 0). Поэтому 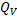 =
= 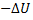 (при V=const) и
(при V=const) и 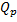 =
=  (при p=const).
(при p=const).
Таким образом если в результате реакции теплота выделяется, а энтальпия системы уменьшается (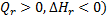 , то это - экзотермическая реакция, н наоборот, поглощение теплоты и увеличение энтальпии (
, то это - экзотермическая реакция, н наоборот, поглощение теплоты и увеличение энтальпии ( 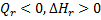 ) характеризует эндотермическую реакцию. Связь между
) характеризует эндотермическую реакцию. Связь между 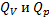 выражается уравнением:
выражается уравнением:
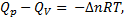
где  п - изменение химического количества газообразных веществ в ходе реакции:
п - изменение химического количества газообразных веществ в ходе реакции:
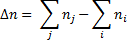
 - химические количества продуктов реакции и исходных веществ соответственно.
- химические количества продуктов реакции и исходных веществ соответственно.
Расчеты в термохимии основаны на законе Гесса (1836): тепловой эффект химической реакции не зависит от пути её протекания, а определяется лишь начальным и конечным состоянием системы при р = const или V= const.
Обычно для расчетов используется не сам закон Гесса, а следствия из него.
Следствие 1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ с учетом их стехиометрических коэффициентов.
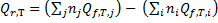 ,
,
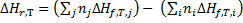 ,
,
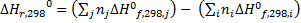 ,
,
Стандартной энтальпией образования вещества (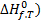 при заданной температуре называют изменение энтальпии в ходе реакции образования одного моля этого вещества из простых веществ, находящихся в наиболее устойчивом стандартном состоянии.
при заданной температуре называют изменение энтальпии в ходе реакции образования одного моля этого вещества из простых веществ, находящихся в наиболее устойчивом стандартном состоянии.
Согласно этому определению, энтальпии образования наиболее устойчивых простых веществ в стандартном состоянии равны нулю при любой температуре. Стандартные энтальпии образования веществ при температуре 298 К приведены в справочниках.
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
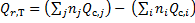 ,
,
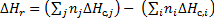 ,
,
где i - продукты реакции,j - исходные вещества,n - стехиометрические коэффициенты.
Стандартной энтальпией сгорания вещества (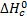 ) называют изменение энтальпии в ходе реакции полного окисления одного моля вещества при стандартных условиях. Стандартная теплота сгорания - это теплота, выделяющаяся при сгорании в атмосфере кислорода 1 моля вещества при стандартных условиях до высших оксидов, причем все участники реакции должны находиться в устойчивых агрегатных состояниях. Это следствие обычно используют для расчета тепловых эффектов органических реакций. Теплоты сгорания веществ определяют калориметрически.
) называют изменение энтальпии в ходе реакции полного окисления одного моля вещества при стандартных условиях. Стандартная теплота сгорания - это теплота, выделяющаяся при сгорании в атмосфере кислорода 1 моля вещества при стандартных условиях до высших оксидов, причем все участники реакции должны находиться в устойчивых агрегатных состояниях. Это следствие обычно используют для расчета тепловых эффектов органических реакций. Теплоты сгорания веществ определяют калориметрически.
Следствие 3 - приближенный метод расчета тепловых эффектов химических реакций по энергиям связей участвующих в реакции веществ. Тепловой эффект химической реакции Q равен разности сумм энергий связей в продуктах реакции и сумм энергий связей в исходных веществах.
Энергией связи А-В называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечно большое расстояние. Энергия связи всегда положительна.
В этом методе расчета сначала предполагают разложение исходных веществ на атомы, а затем образование из них конечного газообразного соединения. Первый этап связан с затратой энергии на разрыв связей в исходных веществах, а второй - с выделением энергии при образовании новых связей. Таким образом, изменение энтальпии системы при химической реакции равно разности энергии разрываемых и образующихся химических связей.
Приближенно энтальпии образования газообразных соединений по энергиям связей можно рассчитать по уравнению:
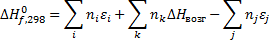
Где 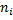 - число связей i -го вида, определяемое по термохимическому уравнению;
- число связей i -го вида, определяемое по термохимическому уравнению; 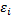 - энергия определенного вида связей в исходных веществах;
- энергия определенного вида связей в исходных веществах; 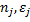 - число связей и энергии образования связей в продуктах реакции;
- число связей и энергии образования связей в продуктах реакции; 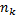 - число атомов в твердом веществе определяемое по термохимическому уравнению;
- число атомов в твердом веществе определяемое по термохимическому уравнению; 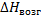 - энтальпия возгонки твердого вещества в
- энтальпия возгонки твердого вещества в
атомарном состоянии.
Метод расчета теплот (энтальпий) образования по энергиям связи целесообразно применять для алифатических органических соединений.
Зная энтальпию образования химического соединения в одном агрегатном состоянии, можно на основе закона Гесса вычислить энтальпию его образования в другом агрегатном состоянии:
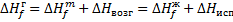
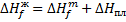
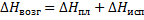
Где 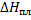
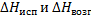 - молярные энтальпии плавления, испарения и возгонки данного химического соединения.
- молярные энтальпии плавления, испарения и возгонки данного химического соединения.
При термохимических расчетах для реакций, протекающих в растворах, надо учитывать тепловые эффекты (энтальпии) процессов растворения химических соединений в данном растворителе. Тепловой эффект (энтальпия) образования химического соединения в растворе, диссоциирующего в нем на ионы, определяется по теплотам (энтальпиям) образования ионов в растворе.
Теплота растворения твердого соединения с ионной кристаллической решеткой определяется в основном суммой двух величин: теплоты разрушения кристаллической решетки и теплоты сольватации ионов молекулами растворителя. В связи с тем, что на разрушение кристалла теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрицательным в зависимости от того, какое из двух слагаемых больше по абсолютной величине.
Прибавление воды к раствору также сопровождается тепловым эффектом - теплотой разведения. Чем разбавленнее раствор, тем теплота разведения меньше. Пользуясь интегральными теплотами растворения, можно вычислить теплоты разведения.
Под интегральной теплотой растворения понимают теплоту растворения 1 моля вещества в бесконечно большом количестве растворителя. Если растворитель химически взаимодействует с растворяемым веществом или вещество, растворяясь, подвергается ионизации, то теплоты растворения таких веществ, указанные в справочниках, включают в себя теплоту сольватации (гидратации) или теплоту ионизации.
При измерении теплоты растворения растворяют g г исследуемого вещества в G г растворителя и определяют при помощи термометра Бекмана изменение температуры.
Расчет ведут по формуле:
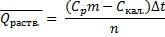
где m - масса раствора (m=G+g); n - химическое количество растворяемого вещества; 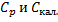 - теплоемкости раствора и калориметра.
- теплоемкости раствора и калориметра.
Для вычисления теплоты растворения 1 моля минеральной кислоты в п молях воды пользуются эмпирическими формулами:
а) НС1+(n+1)Н20.
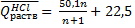 (кДж/моль);
(кДж/моль);
б) H2SO4+nH2O
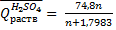 (кДж/моль);
(кДж/моль);
в) HNO3+nH2O
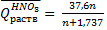 (кДж/моль);
(кДж/моль);
При растворении кристаллогидратов наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Разность между теплотой растворения безводной соли 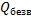 и теплотой растворения се кристаллогидрата Qраств. является теплотой гидратации Qгидр:
и теплотой растворения се кристаллогидрата Qраств. является теплотой гидратации Qгидр:
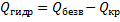
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2350; Нарушение авторских прав?; Мы поможем в написании вашей работы!