
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Замечания и предложения будут приняты по адресу: anesthesiolog@tut.by 1 страница
|
|
|
|
К. С. С.
Содержание
| ЧАСТЬ I КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ | |
| 1. Общие понятия | |
| 2. Буферные системы | |
| 2.1 Бикарбонатный буфер | |
| 2.2 Гемоглобиновый буфер | |
| 2.3 Фосфатный буфер | |
| 3. Компенсаторные механизмы | |
| 3.1 Респираторная компенсация | |
| 3.2 Почечная компенсация | |
| 4. Терминология анализов КЩС и газового состава крови | |
| 4.1 Основные показатели КЩС и газового состава крови | |
| 5. Виды нарушений КЩС | |
| 5.1 Оценка отклонений КЩС | |
| 5.2 Ацидоз | |
| 5.2.1 Респираторный ацидоз | |
| 5.2.2. Метаболический ацидоз | |
| 5.2.2.1 Метаболический ацидоз с увеличенной анионной разницей | |
| Повышенное образование нелетучих кислот | |
| Лактат-ацидоз | |
| Кетоацидоз | |
| Кетоацидоз вследствие голодания | |
| Алкогольный кетоацидоз | |
| Диабетический кетоацидоз | |
| Нарушение выведения нелетучих кислот | |
| Уремия | |
| Нарушения обмена веществ | |
| Прием экзогенных нелетучих кислот | |
| Отравление этиленгликолем | |
| Отравление метанолом | |
| Отравление салицилатами | |
| 5.2.2.2 Метаболический ацидоз с нормальной анионной разницей | |
| Повышенные потери бикарбоната через ЖКТ | |
| Повышенные потери бикарбоната, обусловленные почечной дисфункцией | |
| Диагностика ренального канальцевого ацидоза | |
| Лечение ренального канальцевого ацидоза | |
| Другие причины гиперхлоремического ацидоза | |
| 5.2.3 Применение бикарбоната при СЛР | |
| 5.2.4 Лечение метаболического ацидоза: summary | |
| 5.3 Алкалоз | |
| 5.3.1 Респираторный алкалоз | |
| 5.3.2 Метаболический алкалоз | |
| 5.3.2.1 Частные формы метаболического алкалоза | |
| Хлоридчувствительный алкалоз | |
| Хлоридрезистентный алкалоз | |
| Метаболический алкалоз вследствие увеличенной щелочной нагрузки | |
| 5.3.2.2 Лабораторная диагностика | |
| 5.3.2.3 Лечение метаболического алкалоза | |
| 6. Правила взятия пробы | |
| Послесловие | |
| Suggested readings |
Сначала восходят к аксиомам, а затем спускаются к практике.
Ф. Бэкон
ЧАСТЬ I
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
1. Общие понятия
Согласно определению Бренстеда-Лоури, кислоты – это вещества, диссоциирующие с образованием свободных ионов H+, т. е. являющиеся донором протона, а о снования – вещества, присоединяющие ионы водорода (акцепторы протона).
Сильными кислотами считаются кислоты, подвергающие полной диссоциации, необратимо и легко отдающие [H+], например, HCl. Слабые – частично диссоциирующие, обратимо отдающие [H+], например, H2CO3. Сила оснований, соответственно, определяется способностью активно связывать ионы водорода. Чем сильнее основание, тем больше оно снижает концентрацию [H+] в растворе, например, OH-. Классический пример слабого основания – HCO3-, присоединяющее ион водорода значительно слабее, чем OH-. В организме человека большинство химических соединений представлено слабыми кислотами и слабыми основаниями.
Главными регуляторами кислотно-щелочного равновесия являются углекислый газ и ионы водорода. Водород играет основную роль в образовании кислот и оснований, его концентрация должна находиться в строгих пределах, контролируемых организмом. При отклонении количества ионов водорода от нормального возникают сбои в работе ферментных систем и функциональных белков, порой несовместимые с жизнью.
Некоторое количество [H+] образуется в результате метаболизма биологических веществ – углеводов, жиров и белков. Классический пример биосинтеза протонов – аэробный гликолиз:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Углекислый газ (CO2) фактически является потенциальной кислотой, и, хотя к нему не присоединён ион водорода, он является основным источником [H+]. СO2 вступает в реакцию с водой, образуя угольную кислоту - H2CO3, которая тотчас диссоциирует с образованием протонов:
CO2 + H2O → H2CO3
H2CO3→ H+ + HCO3-
Данная реакция будет двунаправленной, степень отклонения её зависит от концентрации конечных продуктов[1]:
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
Таким образом, при увеличении уровня углекислого газа реакция сдвигается вправо, что приводит к повышению количества водородных ионов.
Второстепенную роль в образовании [Н+] играет превращение двухвалентного железа в трехвалентное (соотношение окисленного и восстановленного гемоглобина):
2Fe++ + 1/2O2 + 2H+ ↔ 2Fe+++ + H2O
Реакция среды любого раствора зависит от количества ионов водорода в растворе. Количество [H+] в артериальной крови составляет 40 нэкв/л[2]. Для сравнения, концентрация натрия во внеклеточной жидкости равна около 140 мэкв/л, что почти в 3,5 миллиона раз выше концентрации ионов водорода. Нормальные колебания концентрации ионов водорода не выходят за пределы 3 – 5 нэкв/л. Количество H+ выше 160 нэкв/л и ниже 10 нэкв/л является несовместимым с жизнью.
Учитывая низкие цифры H+, гораздо более удобно выражать его концентрацию в логарифмической шкале:

 где [H+] выражен в эквивалентах на литр.
где [H+] выражен в эквивалентах на литр.
Логарифм является степенью, в которую нужно возвести основание, чтобы получить число. Например, 107 = 10 000 000, где 10 – это основание, которое нужно возвести в седьмую степень, чтобы получить число 10 000 000. То есть логарифм 10 000 000 по основанию 10 будет равен 7. Логарифм числа по основанию 10 называется десятичным логарифмом и обозначается log10 или lg. Отрицательный десятичный логарифм подразумевает отрицательную степень основания, что применяется при уменьшении значения цифр, например, 10-7 = 0,00000001.
Так как нормальное значение [H+] равно 40 нэкв/л (0,00000004 экв/л), то pH будет равняться:
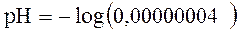
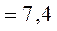
Значения pH, выходящие за пределы 6,8 – 7,8 являются несовместимыми с жизнью. Так как pH является отрицательным логарифмом концентрации H+, то изменение pH обратно пропорционально изменению концентрации водорода (т. е. снижение значения pH ассоциируется с повышением количества H+).
Уравнение Гендерсона-Хассельбальха.
Любая кислота в водном растворе диссоциирует на ион водорода и анион. Баланс этого процесса определяется константой диссоциации кислоты. Например, для угольной кислоты константа диссоциации будет равна:
K´ = H+ × HCO3-/H2CO3. (1)
Отсюда концентрация ионов водорода будет равна:
H+ = K´ × H2CO3/HCO3- (2)
Непосредственно количество H2CO3 подсчитать невозможно, так она быстро диссоциирует. Однако компонент угольной кислоты CO2 находится в плазме в относительно стабильном количестве и отражает общую концентрацию H2CO3. Тогда приведённое выше уравнение можно изменить:
H+ = K × CO2/HCO3- (3)
Константа диссоциации для этого уравнения (K) равна всего 1/400 части от константы диссоциации предыдущего уравнения (K´), так как взаимоотношение между H2CO3 и CO2 равно 1:400.
Общее количество углекислого газа в крови находится в прямой зависимости от PaCO2. В обычных условиях при нормальной температуре коэффициент растворимости для CO2 равен 0,03 ммоль/мм рт. ст. Это значит, что на каждый миллимоль измеренного PaCO2 приходится 0,03 миллимоля H2CO3.
Таким образом, уравнение приобретает следующий вид:
H+ = K × 0,03 × PaCO2/HCO3- (4)
Так как pH = -logH+, константа диссоциации также может быть выражена подобным образом:
pK = -log K
При помощи все того же отрицательного логарифма уравнение 4 можно преобразовать:
-log H+ = -log pK – log(0.03 × PaCO2)/HCO3-
Так как pK = -log K, а pH = -log H+, то предыдущее уравнение можно модифицировать:
pH = pK - log (0.03 × PaCO2)/HCO3-
С отрицательным логарифмом работать не совсем удобно, поэтому можно убрать отрицательный знак, поменяв местами числитель и знаменатель:
pH = pK + log HCO3-/(0.03 × PaCO2)
Для бикарбонатного буфера константа диссоциации рана 6,1, поэтому
pH = 6,1 + log HCO3-/(0.03 × PaCO2)
Последнее уравнение является уравнением Гендерсона-Хассельбальха, позволяющее вычислить pH исходя из концентраций HCO3- и CO2.
Отсюда следует, что pH напрямую зависит от концентрации аниона, в данном случае бикарбоната, и обратно пропорциональна концентрации углекислого газа.
Если оба компонента правой части уравнения Гендерсона-Хассельбальха будут равны, то мы получим log 1, который равен нулю. Тогда pH раствора будет равен pK бикарбонатного буфера:
pH = 6,1 + log 1 = 6,1 + 0 = 6,1
Нормальная концентрация актуального бикарбоната приблизительно равна 27 ммоль/л, а нормальная величина CO2 составляет 40 мм рт. ст., тогда, подставив эти цифры в уравнение Гендерсона-Хассельбальха, получим:


В итоге:
pH = 6,1 + 1,3 = 7,40
Нормальные значения pH плазмы варьируют от 7,35 до 7,45.
Что касается pH не биологических растворов, то если количество [Н+] выше, чем 10-7 ммоль/л, реакция раствора будет считаться кислой, если концентрация ионов водорода менее 10-7 ммоль/л, то реакция считается щелочной. Иначе говоря, все растворы, имеющие pH ниже 7,0 – кислоты, выше 7,0 – основания. При pH = 7,0 концентрация ионов H+ и OH- будет составлять по 50%. Таким образом, при pH = 7,4 реакция плазмы крови человека считается слабощелочной.
Указанные значения pH нормальны только для артериальной крови. Венозная кровь и интерстициальная жидкость имеют pH около 7,35, что связано с повышенным количеством CO2, образующегося в тканях в результате нормального метаболизма.
Нарушения, приводящие к изменению pH более 7,45, называются алкалозом, состояния, вызывающие снижение pH менее 7,35 – ацидозом. Если изменения связаны с отклонениями концентрации HCO3-, то нарушения кислотности будут метаболического характера, если же первопричиной нарушений является изменение PaCO2, то отклонения pH будут респираторными.
Иными словами, если соотношение HCO3-/PaCO2 снижается в связи с уменьшением количества HCO3-, такое состояния относят к метаболическому ацидозу. Если pH снижается в результате увеличения PaCO2, то это будет респираторный ацидоз и наоборот: если соотношение HCO3-/PaCO2 увеличивается в связи с повышением количества HCO3-, такое состояние относят к метаболическому алкалозу, если pH повышается в результате снижения PaCO2, то это будет респираторный алкалоз.
2. Буферные системы
Буферные системы – биохимические комплексы, обеспечивающие постоянство pH путем отдачи либо присоединения ионов водорода. Буферные системы не удаляют H+ из организма, а «связывают» его своим щелочным компонентом до окончательного восстановления КЩС.
Буфер + H+ ↔ H Буфер
Водород взаимодействует с буфером, образуя слабую кислоту. Так как реакция является двунаправленной, то увеличение концентрации водорода вызывает смещение реакции вправо, уменьшение – влево.
В физиологических условиях организмом ежедневно продуцируется около 80 мэкв ионов водорода в составе нелетучих (фиксированных) кислот. К таким кислотам относятся серная, фосфорная, образующиеся в результате окисления тканевых белков и фосфолипидов, а также небольшое количество ацетоацетата и лактата, появляющиеся в результате неполного окисления углеводов и жиров. В это же время нормальная концентрация H+ равна 0,00004 мэкв/л. Поэтому без полноценного функционирования буферов было бы невозможно поддержание стабильного значения pH.
Основными буферными системами являются:
-бикарбонатный буфер [H2CO3/HCO3-] Является основным буфером крови во внешнем пространстве (до 53% от всех буферных систем)
-гемоглобиновый буфер [HbH/Hb-] - 35% от общего количества, является внутриклеточным буфером
-белковый буфер [HPr/Pr-] - 7% от общего количества
-фосфатный буфер [H2PO4-/HPO4-] – 5% от общего количества. Действует преимущественно в костях и моче.
-аммиак/ион аммония [NH3/NH4+] –действует преимущественно в моче.
Буферные системы также делятся на внутриклеточные и внеклеточные. Около 60-70% от общего количества буферов организма приходятся на внутриклеточные, большинство из которых представлены внутриклеточными белками.
Любая буферная система организма состоит из двух частей
-слабой кислоты
-соли слабой кислоты, образованные сильным основанием.
Как говорилось выше, когда оба компонента буферной системы будут равны, то есть будут составлять по 50% от всей буферной системы, pH раствора будет равняться pK буфера. Работа буфера наиболее эффективная, когда значения pH и pK близки. Например, буферная бикарбонатная система будет эффективно работать при цифрах pH от 5,1 до 7,1 (pK±1). За пределами этих цифр сила буфера сильно падает. Когда весь CO2 переходит в HCO3- или наоборот, бикарбонатный буфер полностью теряет свою силу.
Параметры буферных систем:
1. Диапазон буферного действия – это диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK. Так, для бикарбонатного буфера pK будет равно 6,1 ± 1.
2. Буферная ёмкость – это количество кислоты или основания, которое необходимо добавить в буфер, чтобы изменить pH на 1 ммоль/л на ед. pH. Зависит от молярной концентрации буферной системы и от величины pK.
Буферные системы не действуют каждая в отдельности, их работа происходит по принципу сохранения одинаковой концентрации ионов водорода во всех системах. При изменении в одной из буферных систем происходит изменение баланса остальных благодаря сдвигу ионов водорода между ними (hydrogen shift).
Этот процесс (isohydric principle) можно описать формулой:
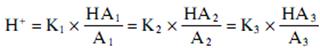
Где K1, K2, K3 являются константами диссоциации трех основных кислот – HA1, HA2, HA3, и A1, A2, A3 – концентрация трех отрицательно заряженных ионов (оснований) соответствующих буферных систем.
2.1 БИКАРБОНАТНЫЙ БУФЕР
Бикарбонатный буфер представляет собой пару слабой кислоты H2CO3 и слабого основания - бикарбоната, а точнее его соли - NaHCO3.
Константа диссоциации бикарбонатного буфера (pK) равна 6,1. Это далеко от среднего значения pH, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3-) системами. Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3/NaHCO3 (CO2/HCO3-).
Как говорилось выше, угольная кислота образуется в результате взаимодействия углекислого газа и воды:
CO2 + H2O ↔ H2CO3
Угольная кислота в свою очередь диссоциирует на водород и бикарбонат:
H2CO3 ↔H+ + HCO3-
Эта реакция также является двунаправленной, только диссоциация вправо проходит немного медленнее.
Бикарбонат в организме во внеклеточной жидкости существует в виде натриевой соли - NaHCO3. Бикарбонатная соль быстро диссоциирует на натрий и бикарбонат:
NaHCO3 → Na+ + HCO3-
Объединив все уравнения вместе, получим следующее:
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
+
Na+
Так как диссоциация угольной кислоты слабая, концентрация ионов водорода в норме очень мала.
Допустим, в буферную систему попала сильная кислота, например, HCL, которая в водном растворе диссоциирует на H+ и Cl-. Имеющийся в бикарбонатном буфере HCO3- («летучий буфер») присоединяет ионы водорода с образованием H2CO3, который, в свою очередь, диссоциирует на воду и углекислый газ. Натрий из бикарбонатного буфера присоединяет оставшийся ион хлора. В целом данная реакция выглядит так:
1. NaHCO3 → Na+ + HCO3-
2. HCL → H+ + Cl-
3. H+ + HCO3- → H2CO3 → H2O + CO2
4. Na+ + Cl- → NaCl
В результате формируется больше угольной кислоты, что в свою очередь увеличивает продукцию углекислого газа и воды. Физиологический смысл этой реакции заключается в том, что поступившая сильная кислота HCl реагирует с HCO3-, превращаясь в слабую кислоту H2CO3. Угольная кислота диссоциирует на H2O и CO2. Избыток CO2 эффективно выводится легкими, причем снижение уровня HCO3- будет отражать количество добавленной кислоты.
Пример 1.
Если количество соляной кислоты будет равно 5 ммоль/л, то количество оставшегося бикарбоната будет равно разности [HCO3-]норма и N, где N – количество добавленной кислоты, то есть: [HCO3-]остаток = 24 ммоль/л – 5 ммоль/л = 19 ммоль/л.
или
5 ммоль/л H+ + 24 ммоль/л HCO3- → H2CO3 → 5 ммоль/л CO2 + H2O + 19 ммоль/л HCO3-
Образовавшийся в ходе реакции CO2 при не нарушенной функции легких выделяется в атмосферу, так что величина PaCO2 не изменится. Помимо того, развивающаяся при ацидозе гипервентиляция будет приводить к гипокарбии. Следовательно, бикарбонатный буфер эффективен для компенсации метаболического, но не респираторного, ацидоза.
Если во внеклеточную жидкость попадает сильное основание, например, NaOH, реакция будет следующей:
NaOH + H2CO3 → NaHCO3 + H2O
Физиологическая роль этой реакции заключается в образовании слабого основания NaHCO3 из более сильного NaOH.
Уменьшение количества H2CO3 в этом случае приводит к сдвигу реакции диссоциации угольной кислоты вправо:
CO2 + H2O → H2CO3 →H+ + ↑HCO3-
+ +
NaOH Na+
Сдвиг диссоциации H2CO3 вправо приводит к снижению количества CO2 в крови. Углекислый газ здесь расходуется на восстановление прежнего уровня угольной кислоты. Уменьшение CO2 приводит к снижению активности дыхательного центра, что вызывает гиповентиляцию. Гиповентиляция замедляет элиминацию углекислого газа, восстанавливая его прежние значения. Избыток образовавшегося бикарбоната эффективно выводится почками.
Уравнение Гендерсона-Хассельбальха для бикарбонатного буфера можно модифицировать:
[H+] = 24 × PaCO2/[HCO3-]
Нормальное содержание PaCO2 около 40 мм. рт. ст., нормальный уровень бикарбоната – 24 ммоль/л, соответственно, нормальная концентрация ионов водорода будет составлять:
H+ = 24 × 40/24 = 40 нмоль/л.
Данное уравнение (уравнение Касье-Блейка) позволяет также вычислить концентрацию ионов водорода по величине pH:
Таблица 1. Взаимосвязь pH и H+
| pH | [H+] нмоль/л |
| 6,80 | |
| 6,90 | |
| 7,00 | |
| 7,10 | |
| 7,20 | |
| 7,30 | |
| 7,36 | |
| 7,37 | |
| 7,38 | |
| 7,39 | |
| 7,40 | |
| 7,41 | |
| 7,42 | |
| 7,43 | |
| 7,44 | |
| 7,50 | |
| 7,60 | |
| 7,70 | |
| 7,80 | |
| 8,00 |
При снижении pH менее 7,40 на каждые 0,01 от заданной величины прирост [H+] будет составлять в среднем 1,25 нмоль/л; при повышении pH на каждые 0,01 от 7,40 снижение [H+] будет составлять 0,8 нмоль/л. Для pH в пределах 7,28-7,45 реальное количество ионов водорода будет соответствовать логарифмически рассчитанному значению по ближайшей 0,01 единице pH. Если pH выходит за указанные пределы, расчетное значение количества H+ будет всегда ниже, чем фактическое, несоответствие будет составлять 11% при pH = 7,1 и 5% при pH = 7,5.
Используя данную таблицу, зная значения pH крови и парциального давления углекислого газа в плазме можно рассчитать концентрацию [HCO3-].
Пример 2.
pH = 7,20
PaCO2 = 28 ммоль/л
Сперва рассчитаем должную величину [H+]. Так как присутствует ацидоз, то количество протонов водорода будет повышено; т. к. нормальному значению pH соответствует значение [H+] = 40 нмоль/л, то уравнение будет выглядеть следующим образом:
[H+] = 40 нмоль/л + [(pHнорма – pHбольного) × 1,25] = 40 + [(40 – 20) × 1,25] = 65 нмоль/л, что приблизительно соответствует табличному значению.
Исходя из уравнения Касье-Блейка,
[HCO3-] = 24 × PaCO2/[H+] = 24 × 28/65 = 10,33 ммоль/л.
Зная, что средние значения PaCO2 составляют 40 мм. рт. ст., уравнение Касье-Блейка можно применить и к примеру 1, рассчитав по нему количество протонов водорода и кислотность измененной среды в целом после буферизации раствора кислоты:
[H+] = 24 × PaCO2/[HCO3-] = 24 × 40/19 = 50,5
Применив таблицу, легко выясним, что кислотность будет приблизительно составлять 7,3. Следовательно, ацидоз в данном случае развивается вследствие потерь бикарбоната, израсходовавшегося на нейтрализацию кислоты.
2.2 ГЕМОГЛОБИНОВЫЙ БУФЕР
Гемоглобиновый буфер является вторым по значимости и мощности буфером после бикарбонатного.
Молекула гемоглобина состоит из четырех связанных полипептидных цепей (глобиновых субъединиц), к каждой из которых прикреплена протопорфириновая (гемовая) группа. Каждая гемовая группа состоит из четырех симметрично расположенных пиррольных (имидазольных) колец, связанных метиониновыми мостиками, с находящимся в центре двухвалентным атомом железа. Ион железа способен связывать молекулу кислорода либо окись углерода - CO. Следовательно, одна молекула гемоглобина может химически присоединить четыре молекулы кислорода (восемь атомов кислорода). Присоединение каждой из четырех молекул кислорода происходит за счет отдельной химической реакции. При присоединении трех молекул кислорода образование четвертой связи резко ускоряется, обеспечивая насыщение кислорода от 25 до 100%. В диапазоне от 90 до 100% скорость насыщения постепенно замедляется, что происходит за счет уменьшения количества доступных мест связывания с кислородом.
Глобиновые субъединицы различаются последовательностью аминокислот, представляют собой две пары полипептидных цепей. В зависимости от вида полипептидных цепей (субъединиц) выделяют несколько типов гемоглобина. Основная фракция гемоглобина (около 96% от всего количества) – HbA1 (hemoglobin adult) состоит из двух α-цепей и двух β-цепей, содержащих соответственно 141 и 146 аминокислотных остатков. Фетальный гемоглобин - HbF (hemoglobin fetal) включает в себя две α-цепи и две γ-цепи, что обеспечивает ему большее сродство к кислороду по сравнению со взрослым гемоглобином. Синтез β-цепей начинается за шесть недель до рождения, практически весь фетальный гемоглобин заменяется на HbA1 в течение первых 4 месяцев жизни.
 В одном эритроците содержится около 340 000 000 молекул гемоглобина, один грамм гемоглобина может переносить до 1,36 мл. O2 (константа Гюфнера). В одном эритроците содержится около 340 000 000 молекул гемоглобина, один грамм гемоглобина может переносить до 1,36 мл. O2 (константа Гюфнера).
|
Гемоглобиновый буфер, в отличие от бикарбонатного, в состоянии нейтрализовать как нелетучие, так и летучие кислоты. Окисленный гемоглобин ведёт себя как кислота, увеличивая концентрацию ионов водорода, а восстановленный (дезоксигенированный) – как основание, нейтрализуя H+. Таким образом, кислотно-основные свойства гемоглобина зависят от степени его оксигенации. В принципе, белки в организме функционируют подобно основаниям, потому что большинство аминокислот имеют отрицательный заряд, то есть способны присоединять H+.
При прохождении эритроцитов через ткани происходит высвобождение кислорода, гемоглобин начинает буферировать ионы водорода. Буферирование осуществляется имидазольной частью гемоглобиновой молекулы, железосодержащая часть отвечает за присоединение молекулы кислорода. Каждая из имидазольных групп может присоединять либо отдавать ионы водорода в зависимости от связи железосодержащей части с кислородом. Иначе говоря, добавление кислорода с одной стороны молекулы гемоглобина вызывает отдачу («выстреливание») протона водорода с другой стороны:
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 650; Нарушение авторских прав?; Мы поможем в написании вашей работы!