
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предполагаемое 3 страница
|
|
|
|
Пример 1. В результате анализа плазмы больного получено: pH = 7,30, PaCO2 = 30 мм рт. ст., HCO3- = 14,2 ммоль/л, альбумин = 4,4 г/дл, фосфаты = 4,3 мг/дл, натрий = 140 мэкв/л, калий = 4 мэкв/л, хлориды = 115 мэкв/л BE = - 10.
Традиционная интерпретация таких анализов свидетельствует об ацидозе с нормальной анионной разницей с наличием дыхательной компенсации.
Степень компенсации рассчитывается по пошаговой модели оценки КЩС-расстройств:
PaСО2 = 1,5 × (НСО3-) + 8(±2) = 1,5 × 14,2 + 8 = 29,3 ± 2
В нашем случае компенсаторный эффект дыхательной системы является адекватным.
Интерпретация с помощью модели Стюарта свидетельствует о низком SID+/низком SIG ацидозе (см. табл. 4).
Используя метод Стюарта, концентрация BE будет подправлена на 0,6 мэкв/л, что соответствует количеству кислоты, «абсорбированной» некарбонатными буферами.
Обе модели (классическая и Стюарта) требуют дифференциального диагноза со следующими состояниями: почечный канальцевый ацидоз, полное парентеральное питание, прием анионных обменных смол, диарея, потеря панкреатического секрета (свищи и т. п.).
Пример 2.
Оставив такие же параметры гомеостаза, как и в предыдущем примере, представим, что уровень альбумина у больного составляет 1,5 г/дл. Используя традиционную модель оценки нарушений КЩС, мы получим те же выводы, что и в примере 1. Однако в интерпретации Стюарта будет наблюдаться низкий SID+/высокий SIG метаболический ацидоз с присутствующей респираторной компенсацией. Учитывая низкое значение β, ΔpH будет выражен больше, нежели ожидается исходя из текущего дефицита оснований. Корригированное значение BE будет на 0,2 мэкв/л больше измеренного, отражая количество кислоты «амортизированной» некарбонатными буферами. Таким способом можно выявить текущий кетоацидоз, лактат ацидоз, отравление салицилатами, метанолом, формиатом (табл. 5 и 6).
Эта теорема пригодна лишь для спора о ней. Г. Лихтенберг
Заключение
Классическая теория Гендерсона-Хассельбальха основана на распределении акцепторных сайтов для иона водорода в бикарбонатном буфере, в то время как модель Стюарта основана на распределении электрического заряда, определяет взаимоотношение между движением ионов через биологические мембраны и последующее изменение pH. Кислотно-основное состояние по современной модели определяется тремя переменными - SID+, ATOT, PaCO2. Уравнение Figge-Fencl разделяет показатель ATOT на составляющие – альбумин и фосфаты, принимая в расчет каждый из заряженных остатков альбумина. Осталась не у дел теория Wooten, на описание которой автор не хотел тратить время, полагая, что излишняя математическая громоздкость будет способствовать худшему усвоению материала. Достаточно знать, что теория Wooten учитывает эффективную работу как и внеклеточных, так и внутриклеточных буферов, внося поправку в расчеты за счет коррекции на уровень гемоглобина, являющимся довольно эффективным буфером.
Очевидная выгода расчета основных показателей современных моделей (SID+, ATOT,) упирается в ограниченные возможности большинства отечественных лабораторий. Расчет фосфатов в плазме может позволить себе только специализированные биохимические лаборатории, поэтому, учитывая невысокие значения фосфатов в плазме, их также можно проигнорировать. В итоге основную корригирующую роль при определении неизмеряемых анионов будет играть альбумин. Таким образом, использование теории Стюарта преследует в основном узкоспециализированные цели. Клиническое применение теории Стюарта ограничено и в настоящих условиях не несет сколь видимых преимуществ по сравнению с классической моделью Гендерсона-Хассельбальха[10].
Знание некоторых принципов легко возмещает незнание некоторых фактов.
К.Гельвеций
ВИДЫ МЕТАБОЛИЧЕСКОГО АЦИДОЗА
5.2.2.1 Метаболический ацидоз с увеличенной анионной разницей
Метаболический ацидоз с увеличенной анионной разницей развивается вследствие накопления нелетучих кислот в организме. Основные причины рассмотрены в таблице 7.
Таблица 7. Причины метаболического ацидоза с увеличенной анионной разницей.
| Причины метаболического ацидоза |
| Повышенное образование нелетучих кислот |
| · Кетоацидоз |
| Ø Сахарный диабет |
| Ø Алкоголизм |
| Ø Голодание |
| · Лактат ацидоз |
| · Нарушения обмена веществ |
| Повышенное поступление экзогенных нелетучих кислот |
| · Этиленгликоль |
| · Метанол |
| · Салицилаты |
| · Паральдегид |
| · Толуол |
| · Сера |
| Нарушение выделения нелетучих кислот |
| · Почечная недостаточность |
| Другие причины |
| · Рабдомиолиз |
| Смешанные состояния |
Накопленные относительно сильные нелетучие кислоты диссоциируют на ион водорода и анионный остаток. Водород эффективно буферируется при помощи HCO3-, образовавшийся CO2 выводится легкими, накопленные анионы замещают потерянный с бикарбонатом отрицательный заряд, поддерживая электронейтральность. Так как количество бикарбоната уменьшается, анионная разница возрастает.
Повышенное образование нелетучих кислот
Лактат-ацидоз
Лактат-ацидоз развивается, как правило, при выраженной гипоксемии тканей, возникающей вследствие нарушения доставки кислорода (гипоперфузия), нарушения транспорта кислорода либо его утилизации.
Клиническая физиология и биохимия лактата
| Метаболизм глюкозы в клетке может протекать тремя путями: · анаэробный гликолиз в цитоплазме – цикл Эмбдена-Мейергофа (Embden-Mierhoff pathway) · аэробный гликолиз в митохондриях – цикл Кребса · прямое окисление глюкозы – гексозомонофосфатный шунт, пентозный цикл Варбурга. Полный аэробный метаболизм глюкозы (цикл Кребса) генерирует 673 ккал энергии, анаэробный гликолиз (цикл Эмбдена-Мейергофа) способен образовать только 47 ккал на каждый моль утилизированной глюкозы (соответственно 36 молекул АТФ и 2 молекулы АТФ на каждую молекулу глюкозы). Третий путь распада глюкозы (цикл Варбурга) образует 117 молекул АТФ из одной молекулы глюкозы. |
При нарушении кислородной доставки в клетку метаболизм глюкозы переключается на анаэробный путь (см. рис. 13).
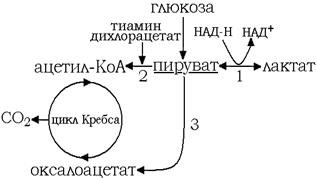
Рис. 13. Краткая схема анаэробного метаболизма глюкозы Цифрами отмечены ключевые ферменты метаболизма пирувата. 1 – лактат-дегидрогеназа, 2 – пируватдегидро-геназа, 3 – пируваткарбоксилаза.
Метаболизм глюкозы до пирувата не требует затрат кислорода, следовательно, образование пирувата является основным звеном анаэробного метаболизма. В дальнейшем пируват способен переходить в оксалоацетат, ацетил-КоА либо лактат.
При отсутствии кислорода пируват превращается в лактат, используя в качестве кофактора НАД-Н.
НАД-Н является ключевым субстратом в образовании АТФ. Проникая в митохондрии, НАД-Н при помощи системы цитохромов окисляется цепью транспорта электронов, образуя в конечном итоге «метаболическую» воду и АТФ. На каждый моль НАД-Н таким образом приходится 2 - 3 моля АТФ. При нормальном содержании кислорода в тканях и не высоком запасе АТФ скорость распада гликогена и окисления глюкозы мала – эффект Пастера.
При гипоксии запасы АТФ быстро исчерпываются, что незамедлительно стимулирует гликолиз. Когда количества кислорода недостаточно для удовлетворения метаболических потребностей цикла Кребса, происходит накопление НАД-Н, вырабатывающегося в клетке до последней секунды, соотношение НАД-Н/НАД+ увеличивается. Так как НАД-Н является одним из основных (помимо ФАДН2) окислителей субстратного метаболизма, то все двунаправленные (равновесные) реакции с вовлечением НАД-Н в качестве кофактора сдвигаются в обратную сторону – сторону восстановления. Таким образом, усиление гликолиза вследствие гипоксии приводит к повышенному количеству пирувата, а так как коферментом обратимой реакции пируват-лактат является уже повышенный НАД-Н, происходит смещение реакции пируват-лактат вправо. Регенерация НАД+ позволяет гликолизу непрерывно протекать в анаэробных условиях. Однако вскоре происходит увеличение соотношения НАД+/НАД-Н, что является свидетельством нарастающего энергетического дефицита.
Несмотря на низкую энергетическую выгоду, анаэробный метаболизм является спасительным для клетки в условиях резко развившейся гипоксии. Тем не менее, при сохраняющейся гипоксии цикл Эмбдена-Мейергофа не в состоянии удовлетворить текущие энергетические потребности клеток и, следовательно, является средством крайней меры для кратковременного (до нескольких минут) поддержания энергетического обмена клетки.
Когда доставка (утилизация) кислорода возобновляется, происходит быстрая обратная реакция перехода лактата в пируват с использованием в качестве кофактора НАД+ и в роли фермента – лактатдегидрогеназу. Следовательно, весь образованный лактат в последующем подвергается обратной конверсии в пируват и служит в качестве альтернативного источника клеточного «топлива». Основными продуцентами лактата являются эритроциты. Они не имеют митохондрий и поэтому не участвуют в дальнейшем метаболизма лактата.
Подавляющее большинство лактата метаболизируется в печени и лишь небольшое его количество утилизируется в других тканях. Например, сердечная мышца может эффективно использовать лактат в качестве дополнительного источника энергии посредством превращения его в пируват и дальнейшего метаболизма последнего до ацетил-КоА. Лактат образуется в организме и в нормальных условиях, но его концентрация в плазме всегда будет менее 2 ммоль/л. При повышенной мышечной работе, особенно у спортсменов, количество лактата может временно превысить этот уровень, однако сохраненный аэробный метаболизм будет эффективно утилизировать лактат как и в печени, так и в сердечной мышце, где лактат будет служить дополнительным энергетическим субстратом.
Следует четко разграничивать понятия гиперлактатемии и лактат-ацидоза. Лактат является отрицательно заряженным ионом, не молочной кислотой. Для того чтобы лактат стал собственно молочной кислотой, необходим ион водорода, получаемый путем гидролиза АТФ. В противном случае гиперлактатемия и лактат-ацидоз являются несопоставимыми понятиями. Дифференциальный диагноз этих двух состояний основан на анализе pH артериальной крови. Если pH сдвинут в сторону ацидоза либо находится в пределах нормы за счет компенсаторного респираторного ответа, можно говорить непосредственно об лактат-ацидозе. Если в плазме наблюдается повышенный уровень молочной кислоты без изменения кислотно-основного состава, состояние следует расценивать как гиперлактатемию.
Причины и классификация лактат-ацидоза
Любое разобщение кислородной связи с митохондрией ведет к активации анаэробного гликолиза. Основная причина лактат-ацидоза – гипоперфузия тканей. Наиболее целостной является классификация причин лактат-ацидоза по Cohen и Woods, предложенная в 1976 году, но до сих пор не потерявшая своей актуальности (см. табл. 8).
Таблица 8. Причины лактат-ацидоза по Cohen & Woods.
| Причины лактат-ацидоза |
| Лактат-ацидоз тип А (гипоксический) |
| · Гипоперфузия и/или гипооксигенация |
| Ø Гиповолемия |
| Ø Сердечная недостаточность |
| Ø Инфаркт миокарда |
| Ø Кровотечение |
| Ø Сепсис |
| Ø ТЭЛА |
| Ø Легочные заболевания |
| Ø Отравление цианидами |
| Ø Отравление угарным газом |
| · Интенсивная работа мышц |
| Ø Судороги |
| Ø Охлаждение |
| Лактат-ацидоз тип Б (без видимой гипоксии) |
| · Системные клинические состояния |
| Ø Алкалоз |
| Ø Декомпенсированный сахарный диабет |
| Ø Дефицит тиамина |
| Ø Заболевания печени |
| Ø Лейкемия |
| Ø Лимфома |
| · Фармакологические вещества |
| Ø Бигуаниды (фенформин) |
| Ø Нитропруссид натрия |
| Ø Адреналин |
| Ø Глюкагон |
| Ø Пропиленгликоль |
| Ø Этанол |
| Ø Салицилаты |
| Ø Фруктоза |
| Ø Сорбитол Ø Антиретровирусные средства (зидовудин, ламивудин) |
| · Ферментативные вещества (нарушение активности) |
| Ø Глюкозо-6-фосфатаза |
| Ø Фруктозо-1,6-дифосфатаза |
| Ø Пируваткарбоксилаза |
| Ø Пируватдегидрогеназа |
| Ø Нарушения в цикле Кребса |
| · Некоторые первичные миопатии |
| · Идиопатический лактат-ацидоз |
Лактат-ацидоз тип А
Подавляющее большинство встречаемых в клинике лактат-ацидозов относятся к типу А. Любое снижение тканевой перфузии в конечном итоге приводит к нехватке кислорода для потребностей цикла Кребса, происходит конверсия пирувата в лактат. Наиболее частая причина у больных в ОИТР – сердечно-сосудистая недостаточность, затем идет шок любой этиологии и сепсис. Причем здесь имеет место не общая гипоксия, а именно тканевая гипоксия. Содержание кислорода в артериальной крови может быть в переделах нормы, однако в связи с блокадой микроциркуляторного русла (гипоперфузия, сладж-феномен, застойная сердечная недостаточность) время прохождения крови через капилляры значительно увеличивается, экстракция кислорода достигает максимума и, затем, при развитии кислородной задолженности, развивается лактат-ацидоз.
При сепсисе имеет место так называемая цитопатическая гипоксия, когда оксигенация тканей может быть не нарушена, но может присутствовать дефект утилизации кислорода в митохондриях. Такое состояние может быть обусловлено эндотоксин-индуцируемым ингибированием пируватдегидрогеназы, осуществляющую окисление пирувата в митохондриях. Дополнительно причиной гиперлактатеми у септических больных является индукция медиаторами воспаления аэробного гликолиза. Так, у гемодинамически стабильных пациентов уровень лактата и пирувата был существенно увеличен, что ассоциировалось с сверхактивированным метаболизмом глюкозы – продукция глюкозы у пациентов с сепсисом в четыре раза превышает таковую у здоровых людей [10]. У больных с эндотоксин-индуцированным РДС-синдромом ведущую роль в производстве лактата играют лёгкие, что подтверждено в экспериментальных моделях на животных – увеличением количества лактата в артериальной крови по сравнению со смешанной венозной.
При кровотечениях единственный механизм развития лактат-ацидоза - это геморрагический шок с активацией анаэробного метаболизма. Выраженная анемия, вплоть до 30 г/л гемоглобина, не вызывает накопления лактата в отсутствие гипоперфузии тканей (при сохраненном ОЦК). Наоборот, обусловленное кровопотерей снижение гематокрита и увеличение сердечного выброса обеспечивает эффективную «прокачку» микроциркуляторного русла. Действительно, основной метод терапии острой кровопотери – возмещение объема ОЦК, лишь затем идет возмещение глобулярного объема.
Возможно развитие физиологического лактат-ацидоза при интенсивной работе мышц, когда кровь не будет успевать эффективно снабжать кислородом перегруженные миоциты, создавая относительный кислородный долг. При прекращении мышечной работы наступает повышенное кровенаполнение мышечной ткани, что способствует «вымыванию» лактата и возобновлению окислительных реакции. Таким образом, наработанный лактат утилизируется как дополнительный источник энергии.
Для лактат-ацидоза типа А характерно непропорциональное увеличение количества лактата по сравнению с пируватом («избыток» лактата), увеличение соотношения НАД-Н/НАД+.
Лактат-ацидоз тип Б
Для лактат-ацидоза типа Б характерно увеличение уровня лактата в крови без признаков сопутствующей гипоксии. Наблюдается взаимное увеличение как лактата, так и пирувата. Такой тип ацидоза характерен при повышенном образовании пирувата, что зачастую обусловлено замедлением других путей его метаболизма. Так, тиамин является кофактором реакции превращения пирувата в ацетил-КоА. При дефиците тиамина происходит накопление пирувата и увеличение его метаболизма по остальным путям, в частности, по пути синтеза молочной кислоты. Следовательно, любой лактат-ацидоз без видимой и/или предполагаемой гипоперфузии/ гипоксии нужно расценивать как лактат-ацидоз вследствие дефицита тиамина.
При парентеральном питании больных с преимущественным применением углеводов последние эффективно метаболизируются циклом Кребса через образование пирувата, в итоге в скором времени наступает истощение запаса тиамина и происходит накопление пирувата с переходом его в лактат. Потому при интенсивном парентеральном питании повышение уровня лактата в крови свидетельствует о необходимости увеличения количества вводимого тиамина. Интенсивный гликолиз также способен вызвать дефицит тиамина, что характерно для гиперметаболических состояний.
Так как лактат в основном метаболизируется в печени, то её тяжелое поражение способно спровоцировать развитие лактат-ацидоза. Однако даже при выраженном нарушении функции печени уровень лактата в крови может быть в пределах нормы, если образование лактата в организме не увеличено и работа альтернативных «утилизаторов» не нарушена. В целом при изолированном нарушении функции печени скорее свойственна гиперлактатемия, не ацидоз.
Одной из причин лактат-ацидоза типа Б в отделениях интенсивной терапии может являться длительное введение лекарственных средств, содержащих в качестве растворителя пропиленгликоль. Пропиленгликоль применяется для увеличения растворимости в воде гидрофобных препаратов, таких как диазепам, лоразепам, эсмолол, нитроглицерин и фенитоин. Помимо местной болезненности по ходу вены, пропиленгликоль может вызывать лактат-ацидоз: первичными метаболитами пропиленгликоля являются пируват и лактат.
Такое состояние должно быть заподозрено у всех больных с необъяснимой гиперлактатемией, получающих длительную инфузию одного из вышеперечисленных лекарств. В таком случае альтернативой должно быть применение препаратов, не содержащих пропиленгликоль, например, мидазолама среди других бензодиазепинов.
Применение контринсулярных гормонов адреналина и глюкагона вызывает интенсивный гликолиз, повышая наработку лактата. Кроме того, адреналин способствует спазму сосудов микроциркуляторного русла, дополнительно формируя лактат-ацидоз типа А.
Антиретровирусные препараты могут разобщать передачу энергии на цитохроме, приводя к тяжелому и подчас летальному лактат-ацидозу.
Пероральные сахароснижающие препараты класса бигуанидов (метформин, фенформин[11]) не совсем понятными механизмами могут вызвать лактат-ацидоз. Предположительно данный эффект обусловлен нарушением прохождения пирувата в митохондрии и активацией анаэробного гликолиза, который в полной мере проявляется при наличии сопутствующей тканевой гипоперфузии.
При длительном введении и применении больших доз нитропруссида натрия продукты его метаболизма – цианидные ионы – вступают в реакцию с цитохромоксидазой, нарушая реакции микросомального окисления. Как результат блокируется аэробный гликолиз и активируется анаэробный, приводя к развитию лактат-ацидоза.
Применение этанола также может активизировать лактатогенез. В процессе своего метаболизма этанол вызывает повышение соотношения НАД-Н/НАД+, что по описанным выше механизмам стимулирует переход пирувата в лактат. Однако на практике такое явление наблюдается весьма редко, в основном в период неумеренного пьянства, гораздо чаще приходится сталкиваться с алкогольным кетоацидозом (см. «кетоацидоз»).
Лейкозы сопровождаются увеличением количества лейкоцитов, что приводит к гиперпродукции лейкоцитами лактата. Повышенная вязкость крови затрудняет капиллярный кровоток, потенцируя гипоксический лактат-ацидоз, а гиперактивность лейкоцитов приводит к превышению потребления кислорода над его доставкой.
Тяжелый алкалоз (респираторный либо метаболический) может быть причиной лактат-ацидоза в результате снижения активности основных ферментов гликолиза. При сохраненной функции печени образованный в результате алкалоза лактат эффективно метаболизируется. Лактат-ацидоз проявляется только при тяжелой алкалемии (pH=7.6 и выше) и при тяжелом нарушении функции печени.
Группа наследственных заболеваний, включающих в себя нарушения метаболизма, является более редкой причиной развития лактат-ацидоза. Она включает в себя дефицит глюкозо-6-фосфатазы (болезнь Гирке), пируваткарбоксилазы, пируватдегидрогеназы и др. Иногда лактат-ацидоз может быть маркером MELAS-синдрома (Mitochondrial Encephalopathy, Lactic acidosis, Strokelike episodes). Этот синдром характеризуется мигренеподобными головными болями, деменцией, потерей слуха, атаксией и периодической рвотой.
В целом большинство состояний, относящихся к типу Б сопровождаются лишь умеренной лактацидемией и развитие значимого лактат-ацидоза возможно только при наличии дополнительных патологических воздействий, иногда достаточно сопутствующей умеренной гипоперфузии тканей, не способной самостоятельно вызвать лактат-ацидоз типа А.
D-лактат-ацидоз
Лактат является оптически активным соединением и существует в виде двух оптических изомеров: левовращающего (L-изомера) и правовращающего (D-изомера). В организме млекопитающих присутствует только левовращающий изомер лактата. D-лактат может образовываться некоторыми видами бактерий. Так, обитающие в кишечнике Bacteroides fragilis и Escherichia coli могут вырабатывать D-изомер лактата, который поступает в системную циркуляцию и вызывает метаболический ацидоз, часто сочетающийся с метаболической энцефалопатией. Такое состояние свойственно для больных с обширной резекцией тонкой кишки (синдром короткой кишки), кишечными анастомозами (особенно еюно-подвздошными анастомозами у лиц с выраженным ожирением) и просто у чрезмерно тучных лиц.
D-лактат-ацидоз можно заподозрить у больных диареей и больных после хирургических вмешательств на кишечнике при наличии у них необъяснимого ацидоза с увеличенной анионной разницей.
Лактат, определяемый лабораторией, является левовращающим изомером, поэтому, при подозрении на D-лактат-ацидоз необходимо провести дополнительное исследование со специальными тест-системами для выявления D-изомера. Такие исследования, к сожалению, весьма дорогостоящи и проводятся в специализированных хорошо оснащенных клинических биохимических лабораториях.
Диагностика лактат-ацидоза
Лактат-ацидоз устанавливается при наличии ацидемии (pH менее 7,35) и повышении уровня лактата в крови выше 2 ммоль/л. Анализ крови для определения лактата должен быть осуществлён в течение 4 часов после её забора. Образец крови должен быть помещен в лед, что снижает скорость метаболизма лейкоцитов и предотвращает выработку в них лактата.
Лактат-ацидоз может сопровождаться увеличением анионной разницы.
Если анионная разница больного выше 16 мэкв/л в отсутствии диабета или почечной недостаточности, то увеличение количества анионов будет свидетельствовать о наличии лактат-ацидоза.
Однако увеличение анионной разницы не всегда сопутствует лактат-ацидозу. Существует множество наблюдений лактат-ацидоза с нормальной анионной разницей, что обусловлено, по-видимому, компенсаторной гиперхлоремией. Такое состояние обусловлено работой хлор-анионного обменника в проксимальных канальцах почек, который абсорбирует ионы хлора в обмен на анионы органических кислот, обеспечивая развитие гиперхлоремии.
Таким образом, показатель AG не может быть использован в качестве достоверного скринингового теста для диагностики лактат-ацидоза. То же касается pH и BE – гиперлактатемия не всегда коррелирует с ацидозом, так как гипервентиляция нормализует pH, а BE может быть изменено вследствие нарушения функции почек, сопутствующих кислотно-щелочных расстройств и снижения уровня альбумина. Прямое измерение лактата в крови при условии правильного технического исполнения – единственный гарант достоверности диагноза.
Вреден ли лактат-ацидоз?
Повышение уровня лактата в крови является неблагоприятным признаком для многих больных. Адекватная кислородная утилизация тканей четко отражается в изменении степени лактатемии. Эффективность терапии больных с сердечно-сосудистой недостаточностью и с сепсисом зачастую оценивается по динамике снижения уровня лактата. Так, степень лактатемии прямо коррелирует со смертностью больных с сепсисом.
Таким образом, лактат является ценным показателем для:
· раннего признака неадекватного снабжения тканей кислородом (при исключении причин группы Б);
· прогностического показателя исхода лечения;
· метода мониторинга и оценки проводимой терапии.
Непосредственно метаболический ацидоз (в данном случае молочнокислый) не несет выраженных неблагоприятных эффектов для организма. Ацидоз способен снижать сократимость миокарда, что было подтверждено опытами на изолированной сердечной мышце животных, но вследствие активации симпатоадреналовой системы (увеличения высвобождения катехоламинов из надпочечников) сердечный выброс увеличивается. Этому способствует также ацидоз-обусловленное снижение общего периферического сосудистого сопротивления, уменьшающее постнагрузку на левый желудочек. Лактат вызывает увеличение пикового давления в левом желудочке, замедляя релаксацию левого желудочка.
Умеренное повышение лактата вызывает также некоторый противовоспалительный эффект, что может играть определенную роль у больных с сепсисом в период предварительного или генерализированного системного ответа.
Таким образом, сам лактат-ацидоз не является основой патологии, но является маркером имеющегося грозного состояния – гипоперфузии, сепсиса и др. Необъяснимая гиперлактатемия может являться важным индикатором тяжелого воспалительного процесса! Исходя из степени лактатемии, можно вычислить приблизительный прогноз для больного – повышение лактата сверх 4 ммоль/л коррелирует с летальностью 11% в течение суток.
Лечение лактат-ацидоза
Лечение лактат-ацидоза должно включать в себя коррекцию вызвавших его причин: улучшение перфузии тканей, оксигенации, отмену препаратов, способствующих развитию лактат-ацидоза типа Б.
Как было сказано, ацидоз не предоставляет собой непосредственную угрозу организму, но является следствием развившихся критических состояний. Поэтому при идентификации лактат-ацидоза необходимо исключить основные причины, способствующие его развитию, исходя из их значимости для больного (см. рис.14).
Как видно из рисунка, основные наиболее вероятные причины лактатемии – сепсис, кардиогенный шок, СПОН, гипоксия. Трудно представить соответствующую ситуацию, когда клиницист, изучив анализ pH и диагностировав лактат-ацидоз, бросается к больному, пытаясь выявить и тут же ликвидировать наиболее вероятные причины. За исключением ситуаций, способствующих развитию лактат-ацидоза типа Б, все первоначальные причины всегда будут манифестировать соответствующими клиническими проявлениями, фактически «бросаясь» в глаза интенсивисту. Оптимально должно быть наоборот – ведя больного с тяжелым сепсисом, СПОН, либо кардиогенным шоком, врач должен заранее предполагать наличие у такого больного лактат-ацидоза и анализ pH в таком случае должен подтверждать ожидаемое. Тогда изменение результатов pH-анализа в динамике должно являться критерием эффективности проводимой терапии основного заболевания.
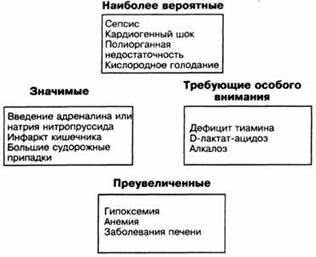
Рис. 14. Дифференцировка основных причин лактат-ацидоза по значимости (Paul L. Marino, 1998)
Терапия щелочными растворами
Применение щелочных растворов может быть оправдано в случае тяжелой ацидемии при цифрах pH ниже 7,1. Если больной переносит такое снижение pH вполне удовлетворительно, применять щелочные растворы не стоит. Когда же гемодинамика больного нестабильная, со склонностью к рефрактерной гипотонии, тогда возможно введение растворов экзогенных щелочей.
Бикарбонат не является эффективным буфером для лечения лактат-ацидоза. Во-первых, введение бикарбоната сопряжено с усилением лактат-ацидоза. По-видимому, такой эффект обусловлен развитием метаболического алкалоза и ингибированием ферментов аэробного гликолиза. Во-вторых, стандартный раствор бикарбоната содержит большое количество CO2. Парциальное давление углекислого газа в 7,5% растворе NaHCO3 составляет не менее 200 мм рт. ст.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 851; Нарушение авторских прав?; Мы поможем в написании вашей работы!