
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия термодинамики
|
|
|
|
Термодинамическая система – это макроскопическая система, состоящая из большого числа частиц, взаимодействие которых между собой и внешними телами определяет состояние системы, характеризующееся внешними аi и внутренними термодинамическими параметрами bi.
Внешние термодинамические параметры ai характеризуют степень внешнего воздействия на систему: напряженность внешнего электрического поля, индукция магнитного поля, силы поверхностного натяжения, объем и т. д.
Внутренние термодинамические параметры bi могут характеризовать систему в целом, например давление, температура. В этом случае их называют интенсивными внутренними параметрами. Также они могут принимать определенные значения в различных точках системы, например намагниченность, поляризованность, влажность. Тогда их называют экстенсивными в нутренними параметрами.
Равновесная термодинамическая система – это такая система, внутренние и внешние параметры которой не изменяются с течением времени, и при этом отсутствуют внешние тепловые потоки.
Термодинамическая система называется открытой,если она может обмениваться с окружающей средой энергией и веществом. По сути дела таковыми являются все реальные системы. Термодинамическая система называется изолированной, если она не может обмениваться с окружающими телами веществом и энергией. Адиабатная система не может обмениваться с внешними телами энергией.
Изменение термодинамических параметров во времени характеризует термодинамический процесс, который может быть равновесным или неравновесным. Поскольку любая система, предоставленная сама себе, с течением времени переходит в равновесное состояние, то вопрос о равновесии и неравновесии термодинамических процессов в системе сводится к вопросу о временных интервалах, в течение которых осуществляется переход к равновесию. Если в результате процесса параметры термодинамической системы изменяются бесконечно медленно, то это равновесный процесс. Неравновесными являются процессы переноса тепла, вещества и импульса, то есть процессы, которые называют теплопроводностью, диффузией и внутренним трением. Они характеризуются наличием в системе градиента в распределении температуры, концентрации и скорости частиц.
Внутреннее состояние равновесной системы, содержащей значительное число частиц, характеризуется температурой, а энергия системы, которая получается из ее полной энергии после вычета кинетической и потенциальной, связанной с полями внешних сил, называется внутренней. Для идеального газа она зависит только от температуры, а для реальных – от внешних параметров и температуры.
Малое изменение внутренней энергии обозначается как d U, то есть является полным дифференциалом, не зависит от вида процесса, а ее изменение определяется только температурой начального и конечного состояний и параметрами самой системы. Значительное изменение внутренней энергии обозначают ∆ U.
Любая термодинамическая система, кроме адиабатной, может обмениваться с внешними телами теплотой. Количество теплоты обозначают Q. Если теплота передается системе, то она считается положительной. Малое количество теплоты, которое передается системе при переходе из одного состояния в другое, достаточно близкое, обозначают d Q. Тем самым подчеркивают, что данная величина не является полным дифференциалом, а зависит от вида термодинамического процесса.
Термодинамическая система может совершать работу, которую обозначают W. Если работа совершается системой, то ее считают положительной, а если над системой – отрицательной. Малую величину работы, совершаемой при переходе из одного состояния в другое, обозначают d W, то есть подчеркивают, что она также не является полным дифференциалом, а зависит от вида процесса. Ее называют также элементарной работой.
Таким образом, для реальных газов и сред можно записать:
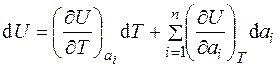 , (1.1)
, (1.1)
где суммирование ведется по всем внешним параметрам.
Для идеального газа изменение внутренней энергии рассчитывают по формуле
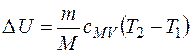 , (1.2)
, (1.2)
где m, M – масса и молярная масса газа соответственно; сMV – молярная теплоемкость при постоянном объеме, которую рассчитывают в зависимости от числа атомов в молекуле и их взаимного расположения (числа степеней свободы) по формуле
 , (1.3)
, (1.3)
где i – число степеней свободы молекулы газа; R – универсальная молярная газовая постоянная, равная 8,31 Дж/(моль·К).
В общем случае элементарную работу можно выразить через изменение внешних параметров системы и обобщенные силы Ai, под которыми необходимо понимать не только силы, вызванные воздействием одних тел на другие, но и градиентами различных физических параметров: температуры, концентрации, импульса, напряженности и т. д. Тогда элементарная работа обобщенных сил определяется выражением
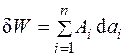 . (1.4)
. (1.4)
В случае расширения системы элементарная работа равна
 ,
,
а полная работа
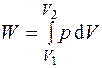 ,
,
где p = const только для изобарного процесса, а в общем случае 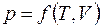 .
.
Для изотермического процесса работа рассчитывается по выражению
 . (1.5)
. (1.5)
При изобарном процессе работу рассчитывают по формуле
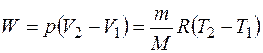 . (1.6)
. (1.6)
Для характеристики теплосодержания системы вводят энтальпию:
 ,
,
которая является однозначной функцией состояния системы, то есть ее изменение не зависит от характера процесса, определяется только начальными и конечными значениями:
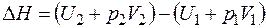 .
.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!