
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплофизические свойства газов
|
|
|
|
Силы взаимодействия между молекулами разреженного газа являются дальнодействующими, их подразделяют на четыре типа: электростатические, дисперсионные, индукционные и резонансные.
Электростатические силы возникают между молекулами, обладающими дипольным моментом. Дипольным моментом не обладают атомы, находящиеся в S -состояниях, двухатомные молекулы, состоящие из одинаковых атомов, а также некоторые многоатомные молекулы, например, метан, диоксид углерода. Наличие зарядов разных знаков у диполей приводит к их определенной взаимной ориентации (эффект Кеезома), что несколько ограничивает свободу их перемещения.
Энергия электростатического взаимодействия описывается выражением
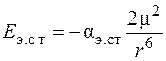 , (2.1)
, (2.1)
где 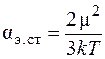 – коэффициент поляризации; μ – дипольный момент молекул; k – постоянная Больцмана.
– коэффициент поляризации; μ – дипольный момент молекул; k – постоянная Больцмана.
В большинстве случаев при количественном описании используют так называемые потенциалы межмолекулярного взаимодействия, знание которых позволяет легко рассчитать силы взаимодействия.
Одним из распространенных потенциалов межмолекулярного взаимодействия является потенциал Леннарда – Джонса:
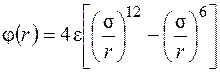 , (2.2)
, (2.2)
где e – минимальная энергия системы из двух молекул; s – минимальное расстояние между двумя молекулами.
Потенциал Леннарда – Джонса применяется для описания свойств газов, молекулы которых приближенно можно считать сферическими.
Для молекул, обладающих дипольным моментом, потенциал взаимодействия описывается выражением
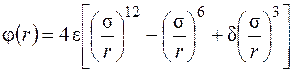 , (2.3)
, (2.3)
где d – функция угловой ориентации молекул.
Рассчитаем молярную теплоемкость разреженных многоатомных газов. Как известно, молярная теплоемкость при постоянном объеме рассчитывается по формуле (поскольку 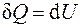 в силу того, что при изохорном процессе работа равна нулю):
в силу того, что при изохорном процессе работа равна нулю):
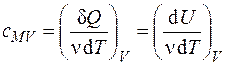 ,
,
где U – внутренняя энергия молекул, имеющая поступательную, вращательную и колебательную составляющие (другие составляющие слабо зависят от температуры, поэтому их не будем учитывать).
Энергия поступательного движения молекулы 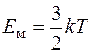 , а суммарная энергия поступательного движения молекул одного моля газа равна:
, а суммарная энергия поступательного движения молекул одного моля газа равна:  .
.
Тогда
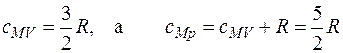 . (2.4)
. (2.4)
Энергия вращательного движения рассчитывается по известной формуле механики
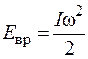 ,
,
где I – момент инерции относительно определенной оси; w – угловая скорость вращения относительно данной оси.
На одну степень свободы приходится энергия 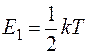 . Тогда для линейных молекул О2, N2, H2, так как вращение учитывается только около двух осей, поэтому энергия вращательного движения таких молекул составляет
. Тогда для линейных молекул О2, N2, H2, так как вращение учитывается только около двух осей, поэтому энергия вращательного движения таких молекул составляет 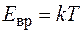 . Молярная теплоемкость двухатомного газа равна:
. Молярная теплоемкость двухатомного газа равна:
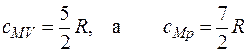 .
.
Для газа, состоящего из нелинейных молекул с числом атомов N три и более:
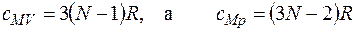 . (2.5)
. (2.5)
Составляющие энергии колебательного движения с учетом кинетической и потенциальной энергии и равномерного распределения энергии по степеням свободы 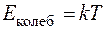 .
.
Анализ формул для расчета теплоемкости разреженного газа показывает, что теплоемкость не зависит от температуры. Но это справедливо только в определенном диапазоне температур. Дело в том, что почти для всех молекул приращение энергии по поступательным степеням свободы значительно меньше kT.
Для колебательных степеней свободы при малых температурах Т энергия квантов становится соизмеримой с kT, что нарушает допущение о равномерном распределении энергии по степеням свободы. В этой связи для нахождения теплоемкости многоатомных газов используют эмпирические методы расчета.
Метод Бенневица – Росснера – Добраца отличается от классических методов расчета тем, что учитывает вклад в энергию колебательных степеней свободы многоатомных молекул с учетом зависимости от температуры.
Пусть молекула имеет N атомов. Тогда у нее (3 N – K) степеней свободы (K – число связей), из которых три поступательные и три вращательные вокруг внешних осей. Оставшиеся (3 N – K – 6) степеней свободы распределяются между колебательными и внутренними вращательными степенями свободы. При этом колебания даже линейного осциллятора рассматриваются вдоль оси осциллятора и перпендикулярно ей в двух направлениях. Это так называемые «изгибающие» (поперечные) колебания. Каждая степень свободы обладает своей характеристической частотой.
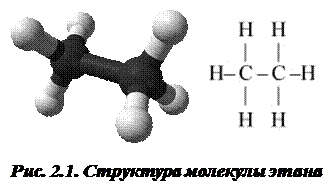 Увеличение теплоемкости за счет внутреннего вращения составляет R /2 на моль для связи типа С–С, С–О, С–N в органических молекулах. Например, структуру молекулы этана можно представить таким образом, как показано на рис. 2.1.
Увеличение теплоемкости за счет внутреннего вращения составляет R /2 на моль для связи типа С–С, С–О, С–N в органических молекулах. Например, структуру молекулы этана можно представить таким образом, как показано на рис. 2.1.
Число внутренних вращательных степеней свободы  отдельных частей молекулы относительно друг друга равно единице. Таким образом, в молекуле с N атомами (N – 1) растягивающих колебаний, а остальные являются изгибающими.
отдельных частей молекулы относительно друг друга равно единице. Таким образом, в молекуле с N атомами (N – 1) растягивающих колебаний, а остальные являются изгибающими.
Энергетический вклад колебательных степеней свободы выражается формулой [2]
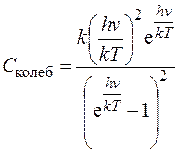 . (2.6)
. (2.6)
При высоких температурах выражение (2.6) стремится к k (на одну молекулу), а в расчете на моль – к R = kNA.
С учетом дополнительных степеней свободы колебаний и внутренних вращений теплоемкость одного моля идеального газа, молекула которого содержит N атомов, можно выразить формулой
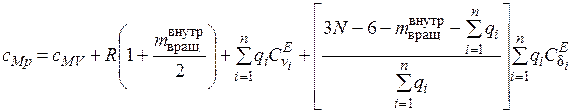 ,(2.7)
,(2.7)
где  – число внутренних вращательных степеней свободы;
– число внутренних вращательных степеней свободы;
сМV = 3 R – вклад в теплоемкость поступательных и вращательных степеней свободы;  – общее число валентных связей;
– общее число валентных связей;  – число изгибающих поперечных колебаний;
– число изгибающих поперечных колебаний; 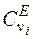 ,
, 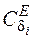 – функции Эйнштейна, которые рассчитываются по формулам [2]:
– функции Эйнштейна, которые рассчитываются по формулам [2]:
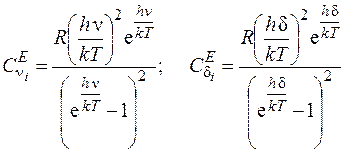 , (2.8)
, (2.8)
где ν, d – характеристические частоты растягивающих (продольных) и изгибающих (поперечных) колебаний.
Функции Эйнштейна аппроксимируются следующим полиномом:
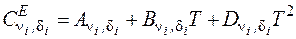 , (2.9)
, (2.9)
где  – коэффициенты полинома. Значения коэффициентов для различных газов приведены в таблице.
– коэффициенты полинома. Значения коэффициентов для различных газов приведены в таблице.
Таблица 2.1
Коэффициенты полинома для функций Эйнштейна
| Колебания | Растяжение – сжатие | Изгибные | |||||
| связь | qi | A ν | B ν∙103 | D ν∙106 | A d | B d ∙ 103 | D d ∙ 106 |
| С–С | –1,09 | 6,0 | –3,441 | 0,73 | 3,414 | –2,577 | |
| С–Н | 0,229 | –1,224 | 1,658 | –0,928 | 3,9 | –1,342 |
При температурах порядка 300 К значения теплоемкости газов, рассчитанных данным методом, ниже экспериментальных, а при высоких температурах – превышают экспериментально измеренные. Данный метод нельзя использовать для соединений с тройными связями.
Пример. Рассчитаем удельную теплоемкость этилена С2Н4 при температуре 373 К.
Решение. Вначале найдем удельную теплоемкость при постоянном давлении по классической формуле (2.5):
 .
.
Экспериментальное значение удельной теплоемкости при постоянном давлении составляет 1,53∙103  . Расхождение результатов между экспериментальным значением и расчетным по классической формуле составляет порядка 200 %.
. Расхождение результатов между экспериментальным значением и расчетным по классической формуле составляет порядка 200 %.
Рассчитаем удельную теплоемкость этилена С2Н4 методом Бенневица – Росснера – Добраца. Значения коэффициентов полинома (2.9) для колебаний растяжения – сжатия и изгибных колебаний связей С–С и С–Н возьмем из табл. 2.1.
Частота колебаний растяжения – сжатия для связей типа С–С составляет 2,97∙1013 Гц, а частота изгибных колебаний для этих связей равна 1,17∙1013 Гц. Аналогичные частоты для связей С–Н составляют 8,76∙1013 Гц и 3,96∙1013 Гц соответственно.
Далее по формуле (2.9) найдем функции Эйнштейна.
а) растяжения – сжатия для связей С–С
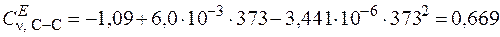 ;
;
б) изгибные для связей С–С
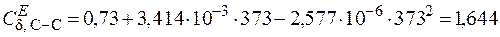 .
.
Далее рассчитаем аналогичные функции Эйнштейна для связей С–Н:
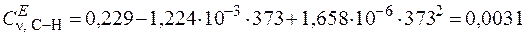 ;
;
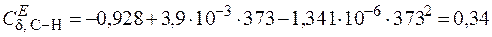 .
.
Найдем сумму функций Эйнштейна для растягивающих и изгибающих колебаний по всем валентным связям:
 ;
;
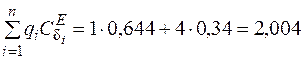 .
.
Затем по формуле (2.7) определим молярную теплоемкость этилена
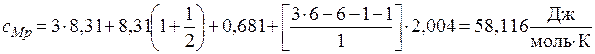 ,
,
а удельная теплоемкость будет равна
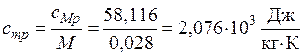 .
.
Экспериментальное значение удельной теплоемкости при постоянном давлении составляет 1,53∙103  . Расхождение результатов между экспериментальным значением и рассчитанным по методу Бенневица – Росснера – Добраца составляет не более 30 %.
. Расхождение результатов между экспериментальным значением и рассчитанным по методу Бенневица – Росснера – Добраца составляет не более 30 %.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1249; Нарушение авторских прав?; Мы поможем в написании вашей работы!