
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третье начало термодинамики
|
|
|
|
Третье начало термодинамики играет значительную роль при описании процессов, протекающих при низких термодинамических температурах, то есть вблизи абсолютного нуля.
Нернст в 1906 г. на основании экспериментальных исследований систем при низких температурах установил, что по мере приближения температуры к 0 К энтропия всякой системы при изотермических равновесных процессах перестает зависеть от каких-либо термодинамических параметров и в пределе принимает одну и ту же постоянную величину, которую можно принять равной нулю.
Математически это можно записать следующим образом:
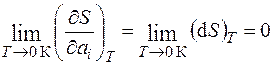 , (1.26)
, (1.26)
где ai – любой термодинамический параметр системы.
Это положение и носит название третьего начала термодинамики.
С позиции статистического смысла энтропии при абсолютном нуле равновесному состоянию термодинамической системы соответствует одно макросостояние, термодинамическая вероятность которого равна единице (w = 1), следовательно, при Т = 0 К:
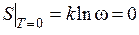 .
.
С позиций статистической физики переход макроскопической системы к равновесию является не обязательным, но такой переход наиболее вероятен.
Существуют и другие формулировки третьего начала.
Применительно к обратимым изохорным процессам из первого начала термодинамики следует:
(W max) V = T (S 2 – S 1) – (U 2 – U 1). (1.27)
Поскольку термодинамический потенциал Гельмгольца (свободная энергия) равен:
F = U – TS, (1.28)
то получаем, что
(W max) V = F 1 – F 2,
то есть работа против немеханических сил совершается за счет убыли свободной энергии. Необходимо также учесть, что
(Q max) V = U 1 – U 2. Тогда с учетом этих положений получаем, что
 .
.
Нернст обнаружил, что по мере приближения к абсолютному нулю:
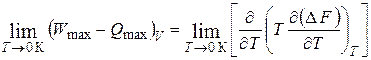 . (1.29)
. (1.29)
Здесь учтено, что из (1.28) следует:
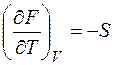 .
.
Третье начало в формулировках Планка следует из аналогичных соотношений, полученных для изобарных процессов:
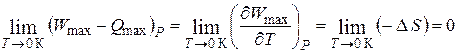 .
.
Учтено, что в сложных системах убыль потенциала Гиббса равна работе против действующих на систему сил различной природы (механических и немеханических), то есть
(W max) P = Ф 1 – Ф 2, а (Q max) P = H 1 – H 2,
где Ф – потенциал Гиббса; Н – энтальпия.
Глава 2. Теплофизические свойства
веществ
Свойства газов, жидкостей и твердых тел в общем случае приведены в соответствующих справочниках. Но диапазон температур технологических процессов необычайно широк – от единиц градусов кельвина до нескольких тысяч. В этой связи справочники не могут обеспечить необходимой информацией о свойствах тел, участвующих в процессе, в таком диапазоне температур. Необходимо уметь хотя бы приближенно рассчитывать теплофизические свойства веществ по тем или иным данным.
Точные расчеты возможны только на основе молекулярно-кинетических представлений для идеальных газов или реальных, но сильно разреженных. Но в то же время путем расчета потенциалов молекулярного взаимодействия можно найти не только термодинамические равновесные характеристики, но и коэффициенты неравновесных процессов с допустимой погрешностью.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!