
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое начало термодинамики
|
|
|
|
Уравнение состояния
Функциональную связь между давлением, объемом и температурой называют термическим уравнением состояния. Для идеального газа (или сильно разреженного газа) – это уравнение Клапейрона – Менделеева
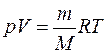 . (1.7)
. (1.7)
Для реальных газов известно множество уравнений состояния. Например, для одного моля газа:
а) уравнение Ван-дер-Ваальса
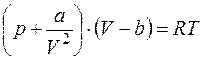 , (1.8)
, (1.8)
где a, b – постоянные Ван-дер-Ваальса,которые различаются для разных газов;
б) уравнение Бертло
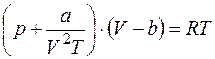 ; (1.9)
; (1.9)
в) первое уравнение Дитеричи
 ; (1.10)
; (1.10)
г) второе уравнение Дитеричи
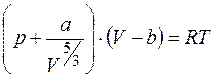 . (1.11)
. (1.11)
Первое начало термодинамики по сути дела отражает закон сохранения и превращения энергии в термодинамической системе в количественной форме. Математически оно записывается следующим образом:
 , (1.12)
, (1.12)
а для элементарного процесса (для малых изменений):
 . (1.13)
. (1.13)
Смысл (1.12) и (1.13) заключается в том, что теплота, сообщаемая термодинамической системе, идет на увеличение ее внутренней энергии и совершение работы.
Для идеального газа в общем выражение (1.13) может быть записано следующим образом:
 , (1.14)
, (1.14)
где внешний параметр аi последовательно принимает значения а 1, а 2, а 3, …, аn, а обобщенная сила Ai – аналогично А 1, А 2, А 3, …, Аn.
Для реального газа необходимо учесть, что внутренняя энергия зависит от внешних параметров, и тогда с учетом выражения (1.1) будем иметь:
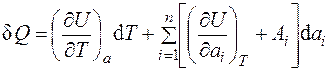 . (1.15)
. (1.15)
Первое начало термодинамики выполняется как для равновесных, так и для неравновесных процессов.
Таким образом, первое начало термодинамики устанавливает количественные соотношения превращения одного вида энергии в другие и ее постоянство для изолированных систем, то есть для системы, которая не обменивается с окружающими телами ни веществом, ни энергией.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 563; Нарушение авторских прав?; Мы поможем в написании вашей работы!