
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение слабой кислоты и соли слабого основания в их смеси
|
|
|
|
Программа работы.
Цель и задачи работы.
Кондуктометрия.
Вопросы для самоподготовки
1. В чем различие методов прямой кулонометрии и кулонометрического титрования?
Какие законы лежат в основе метода кулонометрии? Сформулируйте их.
Каковы особенности метода кулонометрического анализа в амперостатическом и потенциостатическом режимах?
Привести принципиальную схему установки для кулонометрического титрования.
Назвать наиболее распространенные способы фиксирования точки эквивалентности в кулонометрическом титровании.
Привести примеры кулонометрического титрования: а) электрогенерированными окислителями; б) электрогенерированными восстановителями; в) с использованием реакций осаждения и комплексообразования; г) с использованием реакций кислотно-основного взаимодействия.
Укажите достоинства и недостатки кулонометрических методов анализа. Чем ограничена область применения этих методов?
Изучение возможностей и аппаратурного оформления кондуктометрии, овладение приемами практического применения кондуктометрического титрования.
При титровании сильным основанием смесей кислот с солями слабых оснований в растворе реализуются следующие равновесия:
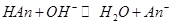
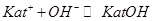
Из расчета теоретических кривых титрования следует, что при значениях 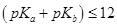 — сначала реагирует кислота, а затем вытесняется слабое основание из его соли; при
— сначала реагирует кислота, а затем вытесняется слабое основание из его соли; при 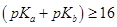 — реакция вытеснения слабого основания из соли предшествует реакции взаимодействия кислоты с титрантом; при значениях
— реакция вытеснения слабого основания из соли предшествует реакции взаимодействия кислоты с титрантом; при значениях 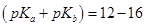 — обе реакции протекают параллельно, дифференцированное титрование невозможно.
— обе реакции протекают параллельно, дифференцированное титрование невозможно.
Для борной кислоты  ; для гидрохлорида гидроксиламина
; для гидрохлорида гидроксиламина  ; следовательно
; следовательно 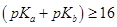 , то есть сначала титруется соль гидроксиламина, а затем кислота.
, то есть сначала титруется соль гидроксиламина, а затем кислота.
Приборы и реактивы:
1. Кондуктометр КП – 001.
Магнитная мешалка.
Стакан вместимостью 250 см3.
Мерная колба вместимостью 100 см3.
Бюретка вместимостью 25 см3.
Пипетка вместимостью 10 см3.
Гидроксид натрия, раствор 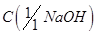 = 0,1 моль/дм3.
= 0,1 моль/дм3.
Борная кислота, раствор  = 1 моль/дм3.
= 1 моль/дм3.
Гидрохлорид гидроксиламина, раствор 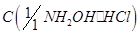 = 1 моль/дм3 .
= 1 моль/дм3 .

Рис. 14.1. Схема установки для кондуктометрического титрования:
1. Измерительный преобразователь кондуктометра. 2. Кондуктометрический датчик. 3. Температурный датчик. 4. Ячейка. 5. Бюретка. 6. Магнитная мешалка.
Ход работы:
14.2.1.1. Установление титра рабочего раствора 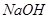 :
:
проводят по пункту 14.2.1.1.
14.2.1.2. Подготовка анализируемого образца к титрованию:
Испытуемый раствор переносят в мерную колбу объемом 100 см3 и доводят его объем до метки дистиллированной водой.
14.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
1. Пипеткой переносят аликвотную часть раствора (10 см3) в ячейку для кондуктометрического титрования и доводят объем его до 250 см 3 дистиллированной водой.
Опускают кондуктометрический датчик и якорь магнитной мешалки в раствор. Раствор должен полностью покрывать рабочую часть датчика.
Включают перемешивание и нажимают кнопку включения на измерительном преобразователе кондуктометра. Записывают значение удельной электропроводности раствора.
При непрерывном перемешивании из бюретки приливают раствор гидроксида натрия (с точным титром определенным по пункту 14.2.1.I) порциями по 0,5 см3 и регистрируют электропроводность получаемых растворов.
Титрование повторяют 3-5 раз.
Результаты измерений записать в таблицу 14.1:
Данные для построения кривой кондуктометрического титрования.
Таблица 14.1.
| № точки | Объем раствора титранта  , см3 , см3
| Удельная электропроводность 
| 
|
Строят кривые титрования в координатах 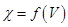 и координатах
и координатах 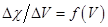 (см. пункт 14.2.1.4).
(см. пункт 14.2.1.4).
Находят средний объем раствора 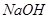 , израсходованный на титрование, и выполняют расчет содержания борной кислоты и солянокислого гидроксиламинав испытуемом образце в граммах по известной формуле с учетом разбавления.
, израсходованный на титрование, и выполняют расчет содержания борной кислоты и солянокислого гидроксиламинав испытуемом образце в граммах по известной формуле с учетом разбавления.
6.2.2. Определение ионов  и
и  в их смеси.
в их смеси.
Определение ионов  и
и  основано на реакции комплексообразования ионов металлов с двунатриевой солью этилендиаминтетрауксусной кислоты (ЭДТА, сокращенная запись
основано на реакции комплексообразования ионов металлов с двунатриевой солью этилендиаминтетрауксусной кислоты (ЭДТА, сокращенная запись  ). В зависимости от
). В зависимости от 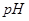 среды при титровании могут образовываться средние и протонированные комплексонаты, а также различные продукты диссоциации этилендиаминтетрауксусной кислоты.
среды при титровании могут образовываться средние и протонированные комплексонаты, а также различные продукты диссоциации этилендиаминтетрауксусной кислоты.
При титровании ЭДТА солей металлов в растворах, не содержащих буферных смесей, на кривой титрования имеется максимум, соответствующий точке эквивалентности. До точки эквивалентности электропроводность раствора растет за счет увеличения концентрации наиболее подвижных ионов  в соответствии с реакцией, происходящей, например, при
в соответствии с реакцией, происходящей, например, при 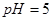 :
:

После точки эквивалентности электропроводность раствора уменьшается в результате связывания  избытком титранта в малодиссоциированную кислоту:
избытком титранта в малодиссоциированную кислоту:
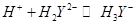
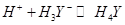
Если при титровании образуется средний комплексонат высокой устойчивости, характеризующийся 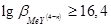 (например,
(например, 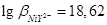 ), то титрование можно проводить в отсутствии буферного раствора. Титрование иона
), то титрование можно проводить в отсутствии буферного раствора. Титрование иона  проводят в присутствии аммиачного буферного раствора. При этом не происходит разрушения ранее образовавшегося комплексоната никеля, так как
проводят в присутствии аммиачного буферного раствора. При этом не происходит разрушения ранее образовавшегося комплексоната никеля, так как 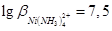 .
.
Приборы и реактивы:
1. Кондуктометр КП – 001.
Магнитная мешалка.
Стакан вместимостью 250 см3.
Мерная колба вместимостью 100 см3.
Бюретка вместимостью 25 см3.
Пипетка вместимостью 10 см3.
Этилендиаминтетрацетат натрия, раствор 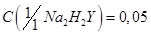 моль/дм3.
моль/дм3.
Хлорид никеля, раствор 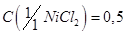 моль/дм3.
моль/дм3.
Хлорид кальция, раствор 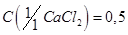 моль/дм3 .
моль/дм3 .
14.2.2.1. Подготовка анализируемого образца к титрованию:
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1219; Нарушение авторских прав?; Мы поможем в написании вашей работы!