
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амперометрическое титрование
|
|
|
|
Вопросы для самоконтроля.
Контрольная задача. Определение солесодержания испытуемого образца воды
Градуировка датчика (составление таблиц)
Определение солесодержания вод скважин.
Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
Проводят по пункту 14.2.1.2.
1. Кондуктометрическое титрование проводят в соответствии с пунктом 14.2.1.3, приливая титрант раствор ЭДТА по 0,5 см3 .
Результаты измерений записывают в таблицу 14.1.
Строят кривую титрования в координатах 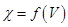 и дифференциальную кривую титрования в координатах
и дифференциальную кривую титрования в координатах
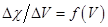 .
.
Находят объем раствора ЭДТА, израсходованный на титрование и выполняют расчет содержания никеля (II) и кальция в испытуемом образце в граммах по известной формуле с учетом разбавления.
Определение солесодержания основано на кондуктометрическом определении концентрации протонов, выделившихся при пропускании солесодержащих вод через катионообменную колонку.
Приборы и реактивы:
1. Кондуктометр КП – 001.
Магнитная мешалка.
Стакан вместимостью 250 см3.
Мерная колба вместимостью 250 см3 – 7 шт.
Колонка (диаметр 15мм, длина 300 мм), содержащая 10 г катионообменника КУ-1 в Н – форме.
Хлороводородная кислота, раствор 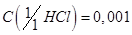 моль/дм3 .
моль/дм3 .
Хлорид натрия, раствор 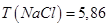 мг/дм3 .
мг/дм3 .
Пипетка вместимостью 2 см3.
Мерный цилиндр вместимостью 200 см3.
Испытуемый образец воды.
Ход работы:
1. Разбавлением исходного раствора 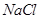 готовят 7 стандартных растворов с концентрацией 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3 по 250 см3 каждого.
готовят 7 стандартных растворов с концентрацией 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3 по 250 см3 каждого.
К 200 см3 первого стандартного раствора добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
Полученный раствор помещают в стакан и опускают в него кондуктометрический датчик. Раствор должен полностью покрывать рабочую часть датчика.
Нажимают кнопку включения на измерительном преобразователе кондуктометра. Заносят значение удельной электропроводности раствора в таблицу 14.2.
Аналогично пропускают через катионообменник и измеряют удельную электропроводность для всех 7 стандартных растворов.
Строят график зависимости удельной электропроводности 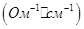 от солесодержания (мг/дм3).
от солесодержания (мг/дм3).
Данные для построения градуировочного графика.
Таблица 14.2
| № стандарта | Удельная электропроводность 
| Солесодержание, мг/дм3 |
1. К 200 см3 испытуемого образца воды добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
Измеряют удельную электропроводность полученного раствора по пункту 14.2.3.1 и значение заносят в таблицу 14.2.
Находят солесодержание по предварительно составленным таблицам или графику.
Рассчитывают солесодержание по формуле:
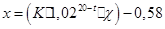
где K- коэффициент датчика, определяемый как отношение солесодержания к удельной электропроводности в любой точке графика;
t – температура пробы, оС;
c - удельная электропроводность, 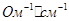 .
.
1. В чем различие прямой и косвенной кондуктометрии? Какой метод более селективен? Почему?
В каком современнном методе анализа используют кондуктометрические детекторы?
Электропроводность раствора азотной кислоты, как показали соответствующие измерения, составляет 0,02273 см. Константа ячейки, в которой проводили измерения, была определена в специальном эксперименте. Рассчитайте концентрацию азотной кислоты в растворе, если константа ячейки равна 0,0053 м-1.
Растворимость 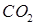 в воде при
в воде при 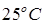 и давлении
и давлении 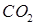 1 атм составляет 1,45 г/дм3. Используя соответствующие величины предельной подвижности ионов и удельной электропроводности воды, находящейся в равновесии с воздухом, рассчитайте степень диссоциации диоксида углерода в воде при
1 атм составляет 1,45 г/дм3. Используя соответствующие величины предельной подвижности ионов и удельной электропроводности воды, находящейся в равновесии с воздухом, рассчитайте степень диссоциации диоксида углерода в воде при 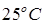 . Мольная доля
. Мольная доля 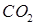 в сухом воздухе равна 0,000314.
в сухом воздухе равна 0,000314.
Кондуктометрическое титрование 10 см3 0,01 моль/дм3 раствора 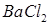 проводилось 0,01 моль/дм3 стандартным водным раствором
проводилось 0,01 моль/дм3 стандартным водным раствором 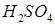 . Рассчитайте удельную электропроводность раствора а) перед началом титрования до добавления серной кислоты, б) в точке эквивалентности и в) после добавления к раствору
. Рассчитайте удельную электропроводность раствора а) перед началом титрования до добавления серной кислоты, б) в точке эквивалентности и в) после добавления к раствору 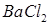 вдвое большего по сравнению с стехиометрическим количеством
вдвое большего по сравнению с стехиометрическим количеством 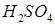 . Суммарным ионным эффектом можно пренебречь. Обсудите, насколько целесообразно такое титрование.
. Суммарным ионным эффектом можно пренебречь. Обсудите, насколько целесообразно такое титрование.
Произведение растворимости сульфата свинца (II) равно приблизительно 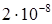 моль2/дм6. Рассчитайте удельную электропроводность насыщенного раствора сульфата свинца (II), полагая, что при нейтральном рН ионы существуют в растворе в виде простых ионов.
моль2/дм6. Рассчитайте удельную электропроводность насыщенного раствора сульфата свинца (II), полагая, что при нейтральном рН ионы существуют в растворе в виде простых ионов.
7.1. Цель и задачи работы:
Ознакомление с техникой и принципом амперометрического титрования, овладение навыками амперометрического титрования.
7.2. Программа работы:
7.2.1. Определение ионов 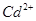 и
и 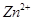 .
.
Определение основано на реакции осаждения ионов цинка и кадмия гексацианоферрат (II) – ионами:
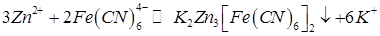
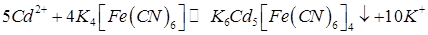
Конечную точку титрования определяют по току электрохимического окисления гексацианоферрат (II) - ионов до гексацианоферрат (III) – ионов на вращающемся платиновом аноде:
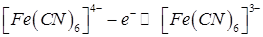
Приборы и реактивы:
1. Установка для амперометрического титрования.
Индикаторный электрод – платиновый вращающийся электрод.
Электрод сравнения - хлорсеребряный электрод.
Гексацианоферрат (II) калия, раствор 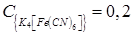 моль/дм 3.
моль/дм 3.
Навеску гексацианоферрата (II) калия (х.ч.) 8,4г растворяют в 200см3 воды, а затем доводят объем до 1дм3 дистиллированной водой. Точное значение молярности устанавливают по стандартному раствору цинка, приготовленному из навески металлического цинка.
Аммонийно-цитратный буферный раствор. Растворяют в 500см3 воды 50г лимонной кислоты и добавляют 80 см3 водного раствора аммиака, 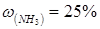 .
.
Сульфат цинка, раствор 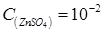 моль/дм3.
моль/дм3.
Мерная колба вместимостью 50 см3.
Бюретка вместимостью 10 см3.
Пипетка вместимостью 10 см3.
Мерный цилиндр вместимостью 50 см3.
Ход работы
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1262; Нарушение авторских прав?; Мы поможем в написании вашей работы!