
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод комплексонометрии
|
|
|
|
Метод комплексонометрии основан на образовании комплексов металл-ионов с комплексонами. К комплексонам Г. Шварценбах отнес группу полиаминополиуксусных кислот, содержащих иминодиацетатные фрагменты -N(CH2COOH)2, связанные с различными алифатическими или ароматическими радикалами. Комплексоны образуют со многими катионами металлов бесцветные, достаточно прочные и растворимые в воде внутрикомплексные соли: комплексонаты, хелаты. В качестве рабочих растворов применяют этилендиаминтетрауксусную кислоту (комплексон II). Анион ее обычно обозначают символом Y. На практике используют чаще ее динатриевую соль Na2H2Y×2H2O (комплексон III, трилон Б), обозначаемую ЭДТА.
Образование комплексоном III внутрикомплексного соединения с каким-нибудь двухзарядным катионом металла происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогрупп за счет координационной связи.
 НOOCH2C CH2COONa
НOOCH2C CH2COONa

 N - CH2 - CH2 - N + Me2+ ®
N - CH2 - CH2 - N + Me2+ ®
NaOOCH2C CH2COOH



 OOCH2C CH2COONa
OOCH2C CH2COONa


 N - CH2 - CH2 - N +
N - CH2 - CH2 - N + 

 NaOOCH2C CH2COO
NaOOCH2C CH2COO

 Ме
Ме
Или в сокращенном виде: Na2H2Y + Me2+ ® [Na2MeY] + 2H+.
Комплексон III образует устойчивые комплексные соединения в соотношении 1:1. В результате реакции комплексона III с ионом металла любой валентности выделяется два иона водорода, поэтому фактор эквивалентности для металлов равен 1/2. Устойчивость комплексонатов различна. Она зависит от природы иона металла, его зарядности и рН среды. При образовании комплекса определяемого катиона с комплексоном освобождаются ионы водорода, рН раствора понижается, поэтому, если титруемые растворы не защищены действием буферной смеси, рН раствора может понизиться на несколько единиц, и комплексные соединения не образуются. Чтобы поддержать рН раствора на заданном уровне, необходимо проводить титрование в буферных растворах, отвечающих определенному значению рН.
Катионы р- и d- элементов (Fe3+, Zn3+, Sc3+, Zr4+ и др.) образуют прочные комплексы в кислой и щелочной среде. Катионы s-элементов (Ca2+, Mg2+, Zn2+) образуют прочные комплексы только в щелочной среде и мешают титрованию катионов, определяемых в кислой среде. Следовательно, титрование большинства S-элементов обычно проводят в аммиачной буферной среде (NH4ОН + NH4Cl) при рН = 8-9. Во избежание образования осадков гидроксидов и с целью маскировки отдельных катионов наряду с буферными смесями добавляют такие вещества, как тартраты, цитраты, фторид натрия, цианид калия и т.д. Благодаря этому удается успешно проводить комплексонометрическое определение боль-шинства катионов прямым, обратным, заместительным способами титрования. Анионы определяют обратным титрованием. Обратное титрование применяют для анализа элементов, не образующих устойчивые комплексы с ЭДТА. При определении анионов, например, сульфид-, сульфат-, фосфат-ионов, их осаждают избытком стандартного раствора какого-либо металла, осадок отделяют и в фильтрате титруют раствором ЭДТА избыток ионов металла, неосадившихся определяемым ионом (анионом).
Для фиксирования точки эквивалентности используют металлохромные индикаторы - органические красители, образующие с катионами металла окрашенные комплексные соединения, цвет которых отличается от цвета свободного индикатора. Например, эриохром черный Т образует с катионами металлов, как правило, комплексы красного цвета в пределах рН = 7-10.




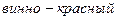
Эти соединения, однако, менее прочны, чем комплексы тех же катионов с комплексоном Ш, поэтому при титровании раствора комплексоном Ш ионы металла переходят от индикатора к комплексону, и выделяется свободный индикатор, имеющий синюю окраску. Таким образом, в точке эквивалентности красная окраска сменяется синей.

вино-красный бесцвет- бесцвет- синий
ный ный
Кроме эриохрома черного Т в комплексонометрическом титровании используют мурексид (аммонийная соль пурпурной кислоты). Мурексид представляет собой темно-красный порошок. Водный раствор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН 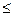 9 - красно-фиолетовый, при рН = 9-10 - фиолетовый, при рН>11 - сине-фиолето-вый. Для титрования марганца, никеля, свинца, цинка, кадмия, меди в среде ацетатного буферного раствора применяют ксиленоловый оранжевый. Индикаторы эриохром черный Т и мурексид употребляют в твердом виде: индикатор смешивают с NaCl (1:200). Эта смесь при титровании добавляется в количестве 0,2-0,3 г. Ксиленоловый оранжевый готовят концентрацией 0,5 % в этаноле. Готовят обычно рабочие растворы ЭДТА с молярной концентрацией эквивалента 0,01-0,05 моль/дм3 из дигидрата ЭДТА
9 - красно-фиолетовый, при рН = 9-10 - фиолетовый, при рН>11 - сине-фиолето-вый. Для титрования марганца, никеля, свинца, цинка, кадмия, меди в среде ацетатного буферного раствора применяют ксиленоловый оранжевый. Индикаторы эриохром черный Т и мурексид употребляют в твердом виде: индикатор смешивают с NaCl (1:200). Эта смесь при титровании добавляется в количестве 0,2-0,3 г. Ксиленоловый оранжевый готовят концентрацией 0,5 % в этаноле. Готовят обычно рабочие растворы ЭДТА с молярной концентрацией эквивалента 0,01-0,05 моль/дм3 из дигидрата ЭДТА  , т.к. он хорошо растворим в воде (108 г/дм3 при 22 оС). При необходимости его возможно получить в чистом виде, и тогда раствор готовят по точной навеске. В большинстве случаев для приготовления рабочего раствора ЭДТА используют препарат, имеющийся в продаже, и готовят раствор по приблизительной навеске. Молярная масса ЭДТА равна 372,25г/моль. Рассчитывают массу ЭДТА, необходимую для приготовления раствора, по формуле:
, т.к. он хорошо растворим в воде (108 г/дм3 при 22 оС). При необходимости его возможно получить в чистом виде, и тогда раствор готовят по точной навеске. В большинстве случаев для приготовления рабочего раствора ЭДТА используют препарат, имеющийся в продаже, и готовят раствор по приблизительной навеске. Молярная масса ЭДТА равна 372,25г/моль. Рассчитывают массу ЭДТА, необходимую для приготовления раствора, по формуле:
 , (58)
, (58)
где m(ЭДТА) - масса ЭДТА, г;
Сэк(ЭДТА) - молярная концентрация эквивалентов раствора ЭДТА, моль/дм3;
Мэк(ЭДТА) - молярная масса эквивалентов ЭДТА, г/моль;
Vм.к. - вместимость мерной колбы, см3.
Молярную массу эквивалентов рассчитывают по формуле:
 . (59)
. (59)
Массу ЭДТА рассчитывают с точностью до второго знака после запятой и взвешивают на технохимических весах. Взвешенную навеску ЭДТА переносят в мерную колбу, растворяют (если раствор мутный его фильтруют), доводят до метки дистиллированной водой и перемешивают. Приготовленный раствор ЭДТА имеет приблизительную (неточную) концентрацию. Точную концентрацию раствора ЭДТА устанавливают по стандартным растворам сульфата цинка или магния, карбоната кальция, хлорида цинка или висмута (III). Раствор ЭДТА следует хранить в обработанных паром склянках иенского стекла. Обычное стекло при длительном хранении раствора дает заметное изменение концентрации раствора. В пищевой промышленности методом комплексонометрического титрования определяют жесткость воды, раздельное содержание кальция и магния в воде. Кроме того, проводят определение макроэлементов кальция и магния и некоторых микроэлементов, например, Fe (III) в пищевых продуктах
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 4155; Нарушение авторских прав?; Мы поможем в написании вашей работы!