
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йодометрия
|
|
|
|
В качестве индикатора используют редокс-индикатор дифениламин. Для того чтобы смена окраски дифениламина происходила в пределах скачка на кривой титрования, необходимо добавлять кислоту Н3РО4, которая связывает образующиеся при реакции ионы Fe3+ в прочный комплекс, понижая тем самым окислительно-восстановительный потенциал этой редокс-пары, что в свою очередь увеличивает скачок на кривой титрования.
Методом дихроматометрии
Цель работы - ознакомиться с методом дихроматометрии, научиться определять железо (II) в соли Мора с использованием редокс-индикатора дифениламина.
Сущность работы. Определение содержания железа (II) в соли Мора проводят в сильнокислой среде, которую создают, добавляя серную кислоту. Титрование железа (II) основано на реакции:
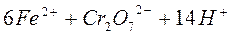
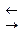
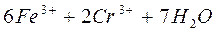 .
.
Оборудование и реактивы: весы аналитические ВЛА-200; мерные колбы, вместимостью 100 и 250 см3; пипетка, вместимостью 25 см3; бюретка, вместимостью 25 см3; мерный цилиндр, вместимостью 25 см3; рабочий раствор перманганата калия, Сэк(KMnO4) ~ 0,02 моль/дм3, (расход 150 см3); раствор соли Мора, Cэк((NH4)2SO4 × FeSO4) ~ 0,5 моль/дм3; Н2SO4 и Н3РО4 (смесь 1:1); дифениламин, w = 1 %; раствор K2Cr2O7, Сэк (K2Cr2O7) ~ 0,05 моль/дм3.
Методика выполнения анализа: 1. Приготовление стандартного раствора K2Cr2O7. Рассчитывают массу навески K2Cr2O7 для приготовления 250 см3 раствора с молярной концентрацией эквивалента 0,0500 моль/дм3 по формуле:
 , (51)
, (51)
где Сэк(K2Cr2O7) - молярная концентрация эквивалентов раствора K2Cr2O7, моль/дм3;
Мэк(K2Cr2O7) - молярная масса эквивалентов K2Cr2O7, г/моль;
Vм.к. - вместимость мерной колбы, дм3.
Навеску соли K2Cr2O7 берут на аналитических весах, количественно переносят в мерную колбу, растворяют, доводят до метки дистиллированной водой и тщательно перемешивают. Если масса навески отличается от расчетной, то производят перерасчет концентрации по формуле (51).
2. Определение содержания железа (II) в растворе соли Мора. Контрольный раствор, содержащий ионы Fe2+, разбавляют до метки дистиллированной водой в мерной колбе и тщательно перемешивают. Отбирают аликвотную часть, прибавляют 15 см3 кислотной смеси (Н2SO4 и Н3РО4) и 1-2 капли дифениламина, титруют раствором K2Cr2O7 до появления устойчивой сине-фи-олетовой окраски. Массу железа вычисляют по формуле:
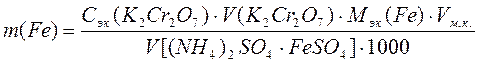 , (52)
, (52)
где m(Fe) - масса железа, г;
Сэк(K2Cr2O7) - молярная концентрация эквивалентов раствора K2Cr2O7, моль/дм3;
Мэк(Fe) - молярная масса эквивалентов железа, г/моль;
V(K2Cr2O7) - объем рабочего раствора K2Cr2O7, израсходованный на титрование, см3;
V[(NH4)2SO4 × FeSO4] - объем аликвотной части раствора соли Мора, см3.
Йодометрическое титрование основано на реакциях восстановления йода до йодид-иона или окисления йодид-иона до йода согласно реакции:
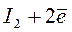
 ,
,  В.
В.
Йод плохо растворим в воде, поэтому с целью увеличения растворимости йода используют не воду, а концентрированный раствор КI, где йод находится в виде комплекса [I3-], поэтому уместна и такая запись:
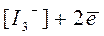
 ,
, 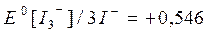 B.
B.
Этим методом можно определять как восстановители, так и окислители. При анализе восстановителей рабочим веществом служит раствор йода в йодиде калия. Восстановители SO3 2-, S2O3 2-, CN -, AsO3 3-, Cr 2+ определяют прямым, а S2- - обратным титрованием. Определение окислителей невозможно прямым титрованием. Для этих целей используют метод титрования заместителя. Заместителем окислителя служит свободный йод, который выделяется в эквивалентном количестве по отношению к окислителю в реакции между окислителем и йодидом калия. Свободный йод оттитровывают рабочим раствором тиосульфата натрия Na2S2O3:

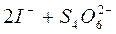 .
.
Ввиду того, что nэк (окисл.) = nэк (заместит.) = nэк (РВ), вычисления проводят как в прямом титровании, опустив средний член тождества. Два тиосульфат-иона передают два электрона, поэтому фактор эквивалентности для йода равен двум, а для тиосульфата натрия - единице.
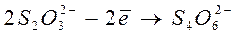
Скорость реакции между окислителем и КI невелика, поэтому к титрованию тиосульфатом натрия приступают спустя 5 минут после добавления сухого КI. Пробу выдерживают в темном месте, что препятствует протеканию побочной реакции окисления ионов йода кислородом воздуха в кислой среде:
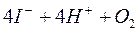
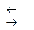
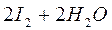 .
.
С целью смещения равновесия реакции между окислителем и КI вправо, а также полного растворения выделившегося I2, добавляют большой избыток реактива КI (1 г).
Фиксирование конечной точки титрования проводят, используя специфический индикатор крахмал, который синеет в присутствии  . Появление синей окраски крахмала объясняется адсорбцией трийодит-иона на амилазе, входящей в состав крахмала. Синее окрашивание наблюдается в том случае, если крахмал свежеприготовленный, в противном случае окраска приобретает коричневый оттенок. Для уменьшения индикаторной ошибки крахмал вводят вблизи точки эквивалентности, когда раствор примет бледно-желтую (соломенную) окраску, титрование продолжают при интенсивном перемешивании до тех пор, пока синее окрашивание не исчезнет полностью.
. Появление синей окраски крахмала объясняется адсорбцией трийодит-иона на амилазе, входящей в состав крахмала. Синее окрашивание наблюдается в том случае, если крахмал свежеприготовленный, в противном случае окраска приобретает коричневый оттенок. Для уменьшения индикаторной ошибки крахмал вводят вблизи точки эквивалентности, когда раствор примет бледно-желтую (соломенную) окраску, титрование продолжают при интенсивном перемешивании до тех пор, пока синее окрашивание не исчезнет полностью.
В пищевой промышленности метод йодометрии используют для определения тяжелых металлов (Pb, Sn, Cu) в консервах и вспомогательных материалах, сернистой кислоты после сульфитации, редуцирующих сахаров в хлебобулочных изделиях.
Определение содержания меди
в растворе CuSO4 методом йодометрии
Цель работы - ознакомиться с методом йодометрии, научиться определять медь (II) - окислитель методом титрования заместителя, используя для фиксирования конечной точки титрования специфический индикатор крахмал.
Сущность работы. Концентрацию рабочего раствора Na2S2O3 устанавливают по раствору дихромата калия K2Cr2O7, который готовят по точной навеске. Определение проводят методом титрования заместителя; заместителем окислителя является I2.


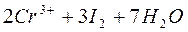



Определение меди осуществляют аналогичным путем, титруя раствором Na2S2O3 выделившийся йод, который образуется в результате реакции:

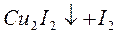 .
.
Конечную точку титрования фиксируют при помощи крахмала.
Оборудование и реактивы: аналитические весы; штатив; бюретка, вместимостью 25 см3; мерная колба, вместимостью 100 см3; стакан, вместимостью 150 см3; колба коническая; мерный цилиндр, вместимостью 10 см3; раствор K2Cr2O7, Cэк(K2Cr2O7) ~ 0,05 моль/дм3; раствор Na2S2O3, Сэк(Na2S2O3) ~ 0,05 моль/дм3; крахмал, w = 2 %; раствор CuSO4, Сэк(CuSO4) ~ 0,25 моль/дм3; KI; H2SO4, Сэк(H2SO4) ~ 2 моль/дм3.
Методика выполнения анализа: 1. Приготовление раствора тиосульфата натрия. Реактив тиосульфат натрия имеет химическую формулу Na2S2O3·5Н2О. Постепенно кристаллизационная вода частично выветривается, поэтому состав соли перестает соответствовать формуле. Вследствие этого растворы тиосульфата натрия готовят по приблизительной навеске. Устанавливают концентрацию спустя 8-10 дней, в течение которых концентрация раствора меняется, т.к. тиосульфат натрия вступает в химическое взаимодействие с растворенными в воде диоксидом углерода, кислородом, а также с микроорганизмами. Навеску соли взвешивают на технических весах, для стабилизации концентрации раствора добавляют Na2СO3 (0,1 г на 1 дм3). Растворы хранят в склянках из темного стекла, закрытых пробками, в которые вставлены трубочки, заполненные натронной известью.
2. Приготовление стандартного раствора K2Cr2O7. Рассчитывают массу навески K2Cr2O7 для приготовления 100 см3 раствора молярной кон-центрации эквивалентов равной 0,0500 моль/дм3 по формуле (51). Навеску взвешивают на аналитических весах, переносят в мерную колбу, растворяют, доводят до метки дистиллированной водой и тщательно перемешивают. Если взятая навеска отличается от расчетной, то пересчет концентрации производят по той же формуле.
3. Установление концентрации рабочего раствора Na2S2O3.Отбирают аликвотную часть раствора K2Cr2O7, добавляют 10 см3 H2SO4 и 1 г сухого KI, хорошо перемешивают, закрывают пробкой (или часовым стеклом) и дают постоять в темном месте 5 мин. Затем пробу вынимают, ополаскивают пробку и стенки колбы дистиллированной водой и титруют выделившийся I2 раствором Na2S2O3. Когда бурая окраска раствора постепенно перейдет в лимонно-желтую, прибавляют 1-2 см3 раствора крахмала и продолжают титровать до тех пор, пока не исчезнет синяя окраска. Расчет молярной концентрации эквивалентов раствора Na2S2O3 производят по формуле:
 , (53)
, (53)
где Сэк(K2Cr2O7) - молярная концентрация эквивалентов установочного раствора, моль/дм3;
V(K2Cr2O7) - объем аликвотной части, см3;
V(Na2S2O3) - объем раствора, израсходованный на титрование, см3.
4. Определение содержания меди в растворе. Контрольный раствор CuSO4 разбавляют водой до метки и тщательно перемешивают. Отбирают аликвотную часть раствора, прибавляют 1 г сухого KI, закрывают пробкой и ставят в темное место на 5 мин. Затем колбу вынимают, ополаскивают пробку и стенки колбы водой и титруют выделившийся йод раствором Na2S2O3, не обращая внимания на образовавшийся осадок Cu2I2. При значительном ослаблении бурой окраски вводят 1-2 см3 крахмала и продолжают титровать до исчезновения синей окраски и появления белой, свойственной осадку Cu2I2. Если синяя окраска раствора не появилась в течение 30 сек, то записывают результат. В противном случае раствор следует дотитровать. Массу меди вычисляют по формуле:
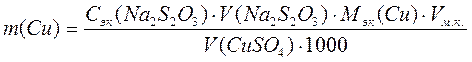 , (54)
, (54)
где m(Cu) - масса меди, находящаяся в контрольном растворе, г;
Сэк(Na2S2O3) - молярная концентрация эквивалентов титранта, моль/дм3;
V(Na2S2O3) - объем титранта, израсходованный на титрование, см3;
Мэк(Cu) - молярная масса эквивалентов меди, г/моль;
Vм.к. - вместимость мерной колбы, см3;
V(CuSO4) - объем аликвотной части раствора, см3.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 5018; Нарушение авторских прав?; Мы поможем в написании вашей работы!