
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дихроматометрия
|
|
|
|
В дихроматометрии в качестве рабочего раствора используют сильный окислитель дихромат калия K2Cr2O7. Стандартный электродный потенциал Е0( /
/ 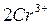 ) = +1,33 B. Реакции окисления-восстановления протекают в кислой среде (z = 6):
) = +1,33 B. Реакции окисления-восстановления протекают в кислой среде (z = 6):

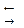
 .
.
Кислую среду создают чаще серной кислотой. Однако можно использовать хлороводородную кислоту, но концентрацией не менее 2 моль/дм3. В противном случае дихромат-ион окисляет Сl-ионы до Cl2. То же самое происходит и при кипячении раствора. Реактив K2Cr2O7 марки х.ч. и ч.д.а. относится к стандартным веществам, поэтому его растворы готовят по точной навеске. В качестве индикаторов в дихроматометрии используют такие редокс-индикато-ры, как дифениламин, дифениламинсульфоновую кислоту. Дифениламин применяют чаще в пищевой промышленности. Метод дихроматометрии используют для определения содержания спиртов в хлебобулочных изделиях и железа в пищевых продуктах.
Определение содержания железа (II)
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 900; Нарушение авторских прав?; Мы поможем в написании вашей работы!