
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганатометрия
|
|
|
|
Методы окислительно-восстановительного
титрования (редокс-метрия)
Редокс-метрия основана на использовании реакций окисления-восста-новления. Определяемое вещество вступает в окислительно-восстановительную реакцию с титрантом. Чем больше величина электродного стандартного окислительно-восстановительного потенциала рабочего вещества, тем большее число восстановителей можно оттитровать с его помощью. Вычисление молярной массы эквивалента в редокс-метрии производят путем деления молярной массы на число электронов, участвующих в полуреакции окисления или восстановления.
Индикаторы, используемые в редокс-метрии, делят на две группы: специфические и редокс-индикаторы. Специфические индикаторы образуют окрашенное соединение либо с окисленной, либо с восстановленной формой окислительно-восстановительной пары. Редокс-индикаторы меняют свою окраску в зависимости от величины электродного потенциала, который меняется в растворе при титровании. Если рабочий раствор окрашен, то может быть использован и безиндикаторный способ фиксирования точки эквивалентности, при этом в точке эквивалентности фиксируют окраску раствора, вызванную небольшим избытком (1-2 капли) титранта.
В основе классификации редокс-методов лежит название рабочего раствора. Так в перманганатометрии рабочим раствором служит КМnО4, в цериметрии - соли Се4+, в дихроматометрии - К2Сr2О7 и т.д.
В методе перманганатометрии в качестве рабочего раствора применяют перманганат калия, который является сильным окислителем. При титровании восстановителей в сильно-кислой среде восстановление марганца идет согласно уравнению (z = 5):


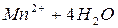 ,
, 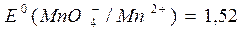 В.
В.
Если растворы слабокислые, нейтральные или слабощелочные, то восстановление протекает с образованием диоксида марганца, выпадающего в виде бурого осадка (z = 3):
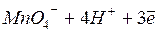
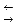
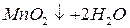 ,
,  В.
В.
В сильно щелочных растворах перманганат-ион восстанавливается до манганат-иона (z = 1):


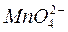 ,
,  В.
В.
Несмотря на то, что окисляющая способность окислительно-восста-новительной пары  выше, чем у
выше, чем у  , в аналитической практике используют титрование в сильнокислой среде. Это связано с тем, что образующийся в среде, близкой к нейтральной, осадок диоксида марганца затрудняет фиксирование конечной точки титрования.
, в аналитической практике используют титрование в сильнокислой среде. Это связано с тем, что образующийся в среде, близкой к нейтральной, осадок диоксида марганца затрудняет фиксирование конечной точки титрования.
Кислую среду создают при помощи концентрированной серной кислоты. Хлороводородную кислоту не рекомендуют использовать, т.к. перманганат-ион или другие промежуточные оксиды марганца могут частично окислять хлорид-ионы до свободного хлора. Титрование в присутствие азотной кислоты может вызвать побочные реакции. Несмотря на кажущуюся простоту суммарных уравнений химических реакций, окисление перманганатом в кислой среде является сложным процессом. Это объясняется тем, что в кислой среде ионы марганца находятся в различных степенях окисления: Mn2+, Mn3+, Mn4+, Mn6+, Mn7+, которые тоже участвуют в химическом взаимодействии.
В перманганатометрии для определения конечной точки титрования в кислой среде не используют внешние индикаторы. Титрование заканчивают в тот момент, когда раствор меняет свою окраску из бесцветной в слаборозовую, которая появляется за счет одной лишней капли раствора перманганата калия. Окраска не должна исчезать в течение 30-ти сек. Однако следует иметь в виду, что избыток КMnO4 обычно разлагается по реакции:


 ,
,
и окраска постепенно исчезает.
Приготовление и хранение раствора КМnO4. Перманганат калия не относится к стандартным веществам, поэтому растворы готовят по приблизительной навеске. Навеску реактива растворяют в горячей воде. Обычно пользуются растворами Сэк(КMnO4)=0,02-0,05 моль/дм3. В первое время после приготовления концентрация раствора КMnO4 несколько изменяется. Это связано с тем, что, являясь сильным окислителем, он вступает в реакции с органическими восстановителями, которые содержатся в воде или попадают в нее с пылью, при этом образуется диоксид марганца, оседающий на дно. Присутствие MnO2 способствует разложению КMnO4, особенно на свету, поэтому растворы хранят в стеклянной посуде, защищенной от пыли, в темном месте или бутылях из темного стекла. Через 7-10 дней осадок MnO2 отделяют либо фильтрованием через стеклянный фильтр, либо сливанием раствора через сифон, осадок при этом остается на дне. Растворы КMnO4 интенсивно окрашены в лилово-красный цвет, поэтому, если плохо виден нижний мениск, все отсчеты по бюретке ведут по верхнему мениску. Растворы КMnO4 из бюретки после работы сливают, затем ее промывают дистиллированной водой. Рекомендуют использовать бюретки со стеклянным краном, так как перманганат калия разъедает резиновые шланги.
Установление концентрации раствора КМnO4. В качестве установочных веществ в перманганатометрии используют свежеперекристаллизованную щавелевую кислоту Н2С2О4 × 2Н2О, оксалат натрия Na2С2О4, высушенный при 105-110 оС в течение двух часов, или оксалат аммония (NH4)2С2О4 × Н2О. Реже используют соль Мора (NH4)2[Fe(SO4)2] × 6H2O, гексацианоферрат (II) калия K4[Fe(CN)6] × 3H2O, As2O3. В зависимости от анализируемого вещества в перманганатометрии могут быть использованы как методы прямого и обратного титрования, так и метод титрования заместителя. Прямое титрование применяют для определения в кислой среде восстановителей, которые легко без потерь окисляются КМnO4, например: Fe2+, As3+, Sb3+, Sn2+, H2O2, Mo3+, карбоновые кислоты (щавелевая кислота, лимонная и др.).
Обратное титрование обычно используют для определения восстановителей, которые медленно окисляются КМnO4, и окислителей, которые предварительно восстанавливают. Например, если к окислителю (персульфату, дихромату, хлорату, нитрату, ванадату и др.) добавить избыточное количество раствора соли железа (II), то часть его пойдет на восстановление, а другая - будет оттитрована раствором КМnO4. Титрование заместителя используют для определения многих металлов (например, серебра) или соединений элементов низших степеней окисления, прибегая к предварительному окислению раствором Fe (III). Образующееся при этом эквивалентное количество железа (II) (заместитель) титруют перманганатом калия.
В пищевой промышленности метод перманганатометрии используют для определения редуцирующих сахаров в мучных и кондитерских изделиях, нитритов в колбасных изделиях, аскорбиновой кислоты и окисляемости воды.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2897; Нарушение авторских прав?; Мы поможем в написании вашей работы!