
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекула
|
|
|
|
7.2.1. Физическая природа химической связи. Ионный и ковалентный типы связи. Молекула водорода. Обменное взаимодействие.
Мельчайшей частицей вещества, сохраняющей все его свойства, является молекула. Молекула состоит из одинаковых или различных атомов, соединённых между собой химическими связями. Устойчивость молекул и их свойства объясняются квантово-механическими закономерностями. Химические связи обусловлены взаимодействием внешних валентных электронов атомов из s- и р-подоболочек с максимальными для данных атомов главными квантовыми числами n.
Существуют две основные формы химической связи: ионная (гетерополярная) и ковалентная (гомеополярная).
Ионная связь.
Теория ионной связи впервые была разработана Максом Борном в 1918 году на примере молекул NaCl.
Согласно этой теории электроны расположены в молекулах так, что у одного из ядер образуется их избыток, а около другого - недостаток. Благодаря переходу внешнего валентного электрона от одного атома к другому, образуется пара разноимённых ионов, взаимодействующих друг с другом электростатическими силами. Например, в молекуле NaCl, атомы которой имеют электронную конфигурацию 1s22s22р63s1(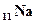 ),1s22s22р63s23р5(
),1s22s22р63s23р5(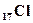 ), электрон с 3s1-подоболочки натрия переходит в 3р5-подоболочку хлора. В результате образуются положительный ион натрия Na+ (1s22s22р6) и отрицательный ион Cl- (1s22s22р63s23р6). С точки зрения квантовой механики при ионной связи образуется устойчивая электронная конфигурация s-p-подоболочек инертных элементов, обладающая наименьшей энергией.
), электрон с 3s1-подоболочки натрия переходит в 3р5-подоболочку хлора. В результате образуются положительный ион натрия Na+ (1s22s22р6) и отрицательный ион Cl- (1s22s22р63s23р6). С точки зрения квантовой механики при ионной связи образуется устойчивая электронная конфигурация s-p-подоболочек инертных элементов, обладающая наименьшей энергией.
Ионным типом связи обладают соединения KCl, NaBr, CsF, MgO, CaO и др.
Ковалентная связь.
Теория ковалентной связи была разработана Ф.Лондоном и В.Гайтлером в 1927 году. Согласно этой теории часть электронов движется около обоих ядер. Химическая связь двух соседних атомов осуществляется обобществлёнными валентными электронами, имеющими антипараллельные спины.
Ковалентным типом связи обладают молекулы Н2, С2, CO, ZnS и др.
Простейшей молекулой с ковалентной (гомеополярной) связью является молекула водорода, состоящая из двух протонов и двух электронов.
Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это чисто квантовый эффект, не имеющий классического объяснения, но его можно представить себе так, что электрон каждого из атомов молекулы водорода некоторое время проводит у ядра другого атома. Другими словами, атомы при сближении на расстояние порядка боровского радиуса начинают непрерывно обмениваться друг с другом своими электронами. При этом возникает взаимное притяжение атомов и образуется устойчивая молекула.
Молекула водорода является квантовой системой и описывается уравнением Шрёдингера, учитывающим а) движение электрона в молекуле, б) колебания атомов в молекуле и с) вращение молекулы.
Решение этой задачи очень сложное. Обычно её решают отдельно для электронов и отдельно для ядер.
Если, например, ядра считать неподвижными, то уравнение Шрёдингера принимает относительно простой вид и его решение было получено методом Гайтлера-Лондона.

|
Ионная и ковалентная связи являются предельными. Как правило, образуются смешанные связи - частично ионные и частично ковалентные.
7.2.2. Энергетическая структура молекул. Электронные термы двухатомной молекулы. Колебания и вращения двухатомной молекулы. Молекулярные спектры.
Энергия изолированной молекулы W зависит не только от электронной конфигурации атомов, то есть от энергии движения электронов вокруг ядер We ( электронная энергия), но и от энергии колебаний молекулы Wv ( колебательная, или вибрационная, энергия), при которых меняется расстояние между ядрами, и от энергии вращения ядер Wr ( вращательная, или ротационная, энергия), при котором меняется ориентация молекулы в пространстве:
W = We + Wv + Wr. (1)
Поскольку энергия квантового гармонического осциллятора квантуется, то
Wv = (v + 1/2) 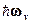 , (2)
, (2)
где v = 0,1,2,3,... - колебательное квантовое число, для которого существует правило отбора Dv = ±1, wv - частота колебаний молекулы.
Вращательная энергия молекулы, имеющей момент инерции I, частоту вращения wr и квантованный момент импульса L = 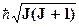 , также имеет квантованные значения: Wr =
, также имеет квантованные значения: Wr = 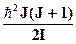 , (3)
, (3)
где J = 0,1,2,3,... - вращательное квантовое число, для которого существует правило отбора DJ = ±1.
Таким образом, полная энергия молекулы (2) равна: W = We + (v + 1/2) 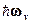 +
+ 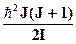 . (4)
. (4)
Вклад в полную энергию электронной, колебательной и вращательной её составляющих различный и примерно кратен отношениям: We: Wv: Wr = 1: 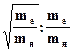 ,
,
где me и mя - масса электрона и масса всех ядер молекулы соответственно.

|
Поскольку me/mя» 10-5¸10-3, то We >> Wv >> Wr.
Известно, что We» 1¸10 эВ, Wv» 10-2¸10-1, Wr» 10-5¸10-3.
Электронная, колебательная и вращательная энергии молекулы квантуются и им соответствуют наборы дискретных энергетических уровней.
Из теории и эксперимента следует, что расстояния между вращательными уровнями значительно меньше расстояния между колебательными уровнями, а расстояния между колебательными уровнями значительно меньше расстояния между электронными уровнями.
На рис.2 представлены энергетические уровни двухатомной молекулы.
При переходе с одного уровня на другой испускается или поглощается энергия DW = hn = 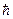 w. Спектры излучения и поглощения молекул определяются структурой их энергетических уровней.
w. Спектры излучения и поглощения молекул определяются структурой их энергетических уровней.
Например, для вращательных спектров:
DWr = 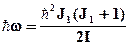 -
- 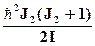 .
.
Поскольку в соответствии с правилом отбора DJ = ±1, то J1 = J + 1, а J2 = J и
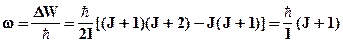 .
.
Спектр в этом случае имеет вид:
w1 = 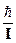 (J = 0); w2 = 2w1 (J = 1); w3 = 3w1 (J = 2); Dw = w1.
(J = 0); w2 = 2w1 (J = 1); w3 = 3w1 (J = 2); Dw = w1.
Измеряя Dw, можно определить момент инерции молекулы. Зная массу ядер, можно найти равновесное расстояние между ними в двухатомной молекуле.
Частоты спектральных линий излучения любого атома или молекулы могут быть представлены в виде разности двух спектральных термов: w = Т(n2) - T(n1), где n1 и n2 - некоторые целые числа. Составляя различные комбинации спектральных термов, можно найти все возможные частоты спектральных линий атома или молекулы. В этом состоит комбинационный принцип Ритца.
Спектр молекул довольно сложный. При разных типах переходов между энергетическими уровнями возникают различные типы молекулярных спектров - электронные, колебательные, вращательные, электронно-колебательные и колебательно вращательные.
Типичные молекулярные спектры - полосатые, представляющие собой совокупность более или менее узких полос в ультрафиолетовой, видимой и инфракрасной областях.
Полосы представляют собой тесно расположенные линии, которые можно различить только в приборах с высокой разрешающей способностью. Чем больше атомов в молекуле, тем сложнее структура спектра. Колебательными и вращательными спектрами обладают только многоатомные молекулы. Двухатомные молекулы, которые не имеют дипольного момента (симметричные молекулы), что является необходимым условием квантовых переходов, не имеют колебательный и вращательный спектры. Молекулы, состоящие из разных атомов (несимметричные молекулы), имеют колебательные и вращательные спектры. Электронно-колебательныеспектры наблюдаются как у несимметричных, так и симметричных молекул. Изучая молекулярные спектры, можно исследовать строение и свойства молекул. Эти методы используются в молекулярном спектральном анализе, в лазерной спектроскопии.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1098; Нарушение авторских прав?; Мы поможем в написании вашей работы!