
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства
|
|
|
|
Задачи термодинамики. Внутренняя энергия. Ее свойства. Квазистатические процессы.
Термодинамика является аксиоматической наукой, она не вводит каких-либо конкретных представлений о строении вещества и физической природе теплоты. Ее выводы основаны на общих принципах или началах, которые являются обобщением опытных фактов. Теплота рассматривается как какое-то внутреннее движение без его конкретизации.
Задачи термодинамики: научиться описывать свойства вещества и их зависимость от внешних условий, опираясь от преставления о внутренней энергии вещества и теплоте.
Вопросы: 1) Возможен или нет данный процесс в данной термодинамической системе?
2) Если процесс возможен, то в каком направлении, он будет развиваться?
3) Когда процесс закончится?
Внутренняя энергия – сумма кинетической энергии теплового движения молекул и потенциальной энергии взаимодействия молекул вещества друг с другом U=EK+EП
1) U=U(T,V)
2) для ИГ U(T)=1/2 RT(определяет внутреннюю энергию 1 моля ИГ)
3) Понятие энергии определяется только для ТД равновесных состояний
4) U – функция ТДС (dU)
5) ∆U участвует в работе и теплообмене
В рамках молекулярно-кинетической теории внутренняя энергия макроскопического тела U определяется как среднее значение суммы всех кинетических энергий хаотического движения молекул или атомов тела и потенциальных энергий взаимодействия всех молекул друг с другом. Вычисление внутренней энергии произвольного тела представляет очень сложную (иногда невыполнимую) задачу. Для идеального газа задача упрощается, так как в этом случае потенциальной энергией взаимодействия молекул (атомов) пренебрегают. Таким образом, внутренняя энергия идеального газа равна среднему значению суммарной кинетической энергии молекул газа, заполняющих данный объем: U = N<E>, где <E> - средняя кинетическая энергия молекул. Так как <E> = (3/2)kT, то приходим к формуле: 
выражающей внутреннюю энергию идеального газа через его температуру Т и количество молей газа. Иначе формулу можно представить в виде: 
Эта формула справедлива для идеального одноатомного газа, атомы которого движутся только поступательно. Из нее следует, что внутренняя энергия идеального газа есть функция только температуры газа и его количества и не зависит от занимаемого газом объема.
Для реальных газов, жидкостей и твердых тел внутренняя энергия является функцией как температуры, так и объема.
Термодинамический процесс – процесс перехода ТДС из одного равновесного состояния в другое.
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.
Значение квазистатических процессов
Основное значение квазистатических процессов состоит в том, что данная модель значительно упрощает исследования в области термодинамики. Такая легкость объясняется тем, что при мгновенном описании состояния системы, совершающей квазистатический процесс, требуется одинаковое количество параметров, как и для макроскопического описания равновесного состояния. Квазистатические процессы не реализуются в природе, но являются хорошей моделью для приближения процессов, протекающих достаточно медленно (для квазистатического процесса скорость изменения макроскопического параметра должна удовлетворять условию, где — время релаксации, — характерный масштаб изменения величины).
Виды квазистатических процессов
В термодинамике часто встречаются следующие квазистатические процессы:
Изохорный процесс-процесс, происходящий при постоянном объеме;
Изобарный процесс- процесс, происходящий при постоянном давлении;
Изотермический процесс- процесс, в котором температура остается постоянной;
Адиабатический процесс- процесс, который совершается без подвода или отвода тепла;
13. Теплота. Теплоёмкость.
Теплоёмкость идеального газа в изопроцессах.
В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости.
Теплоемкость - количество теплоты необходимое для нагревания тела на один Кельвин (9.11) 
Удельной теплоемкостью называется величина, числено равная теплоте, которую надо сообщить единице массы тела для повышения его температуры на один Кельвин: (9.12)

Отсюда можно определить количество теплоты, необходимое для нагревания вещества, массы m (9.13) 
Молярная теплоемкость - количество тепла необходимое для нагревания одного моля вещества на один Кельвин (9.14) 
Воспользовавшись I законом термодинамики выражение (9.11) можно переписать в виде (9.15) 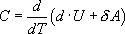 , откуда следует, что теплоемкость есть функция процесса, т.е. теплоемкость системы зависит от того каким образом система переходит из одного состояния в другое. Вообще говоря, таких процессов может быть сколько угодно, фактически же используются чаще всего теплоемкость при р=const(Cp) и при V=const(CV).
, откуда следует, что теплоемкость есть функция процесса, т.е. теплоемкость системы зависит от того каким образом система переходит из одного состояния в другое. Вообще говоря, таких процессов может быть сколько угодно, фактически же используются чаще всего теплоемкость при р=const(Cp) и при V=const(CV).
ТЕПЛОТА, кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит. Мерой интенсивности движения молекул является температура. Количество теплоты, которым обладает тело при данной температуре, зависит от его массы; например, при одной и той же температуре в большой чашке с водой заключается больше теплоты, чем в маленькой, а в ведре с холодной водой его может быть больше, чем в чашке с горячей водой (хотя температура воды в ведре и ниже).
Теплоемкость идеального газа в изопроцессах
В адиабатическом процессе теплообмена с окружающей средой не происходит, т.е. δQ=0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0.
В изотермическом процессе постоянна температура, т.е. dT = 0. Следовательно, теплоемкость идеального газа стремится к бесконечности: 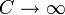
В изохорическом процессе постоянен объем, т.е. δV = 0. Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение (δA = δVP). Первое Начало Термодинамики для изохорического процесса имеет вид:
dU = δQ = CVΔT
А для идеального газа 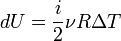 Таким образом,
Таким образом,  где i - число степеней свободы частиц газа.
где i - число степеней свободы частиц газа.
В изобарическом процессе (P = const)
δQ = dU + PdV = νCVΔT + νRΔT = ν(CV + R)ΔT = νCPΔT
CP=δQ/νΔT=CV+R=(1+i/2)*R
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 821; Нарушение авторских прав?; Мы поможем в написании вашей работы!