
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторная работа
|
|
|
|
Занятие 10. Гравиметрический метод анализа
Цель: Сформировать умения и навыки по выполнению гравиметрического анализа и проведению расчетов в весовом методе.
Задачи: Приобрести навыки работы с аналитическими весами, овладеть техникой декантации и фильтрования, познакомиться с техникой проведения озоления, научиться проводить расчеты в гравиметрическом анализе.
Основные вопросы темы:
Основы метода гравиметрического анализа.
Техника проведения фильтрования и декантиции.
Осаждение и соосаждение.
Расчеты в весовом анализе. Решение задач
Теоретические основы метода: Сущность гравиметрического весового анализа заключается в том, что анализируемое вещество переводят в раствор, после чего определяемый элемент осаждают в виде какого-либо трудно растворимого соединения (или выделяют в свободном состоянии). Выпавший осадок отделяют фильтрованием, тщательно промывают, прокаливают (или высушивают) и точно взвешивают на аналитических весах. По весу осадка и его формуле рассчитывают содержание в нем определяемого элемента в процентах от навески. Весовым Методом определяют кристаллизационную воду в солях, гигроскопическую воду в почве, многие элементы в минералах и т.д.
В ходе анализа различают следующие операции:
1. Отбор средней пробы вещества и подготовка ее к анализу;
2. Взятие навески;
3. Растворение;
4. Осаждение определяемого элемента (с пробой на полноту осаждения);
5. Фильтрование;
6. Промывание осадка (с пробой на полноту промывания).
7. Высушивание и прокаливание осадка;
8. Взвешивание;
9. Вычисление результатов анализа.
“Определение содержания бария в хлориде бария”
Навеску образца, содержащего некоторое количество BaCl2 ×2H2O, растворяют в воде, осаждают ион бария в виде сульфата BaSO4 и по массе последнего вычисляют результат. Реакция осаждения протекает по уравнению:
Ba2+ + SO42- «BaSO4¯
Сульфат бария удовлетворяет большинству требований, предъявляемых к осадкам; он малорастворим (ПРBaSO4 = 1,1×10-10), устойчив на воздухе, его состав строго соответствует формуле.
В качестве осадителя используют серную кислоту. Сульфат бария образует очень мелкие кристаллы, проходящие через порода фильтра. Поэтому в ходе анализа создают условия, обеспечивающие получение крупных кристаллов.
Перед началом определения тщательно моют посуду, прокаливают тигель до постоянной массы.
Взятие навески и ее растворение Получите у лаборанта задачу для определения содержания ионов Ba2+.
Осаждение К полученному раствору хлорида бария прибавьте 5 мл 0,2н раствора HCl, нагревайте на плитке (на асбестовой сетке) почти до кипения (кипение недопустимо, так как возможно разбрызгивание и будут потери Ba2+). Параллельно в другом стакане (или колбе) нагревайте до кипения 15 мл 0,2 н. н2SO4. Затем горячий раствор серной кислоты очень медленно, по каплям, при непрерывном перемешивании палочкой приливайте к горячему раствору BaCl2. Старайтесь не касаться палочкой дна и стенок стакана при перемешивании, так как осадок плотно прилипнет к стеклу, Поэтому, не вынимая палочку из стакана, поставьте стакан с жидкостью и осадком на горячую водяную баню, дайте им отстояться.
Когда раствор над осадком станет прозрачным, сделайте пробу на полноту осаждения: по стенке стакана прибавьте к раствору 2-3 капли н2SO4. Если не появится муть, то сульфат бария больше не образуется и полнота осаждения ионов Ba2+ достигнута. В обратном случае еще добавьте в стакан горячего раствора н2SO4, хорошо перемешайте и дайте отстояться.
Когда полнота осаждения ионов Ba2+ будет достигнута, не вынимая палочку, накройте стакан листом бумаги и оставьте на один час для созревания осадка при температуре 60 - 70° С.
Фильтрование и промывание осадка Возьмите беззольный фильтр "синяя лента", подгоните его к воронке, поместите воронку в кольцо штатива, поставьте под воронку чистый стакан, чтобы конец воронки касался стенки стакана. Затем осторожно по стеклянной палочке декантируйте (сливайте) прозрачную жидкость с осадка на фильтр. (Следует помнить, что прежде чем вливать новую порцию жидкости на фильтр, надо дать стечь до конца предыдущей). Одновременно приготовьте промывную жидкость. В промывалке в 200-300 мл дистиллированной воды прибавьте 8-10 капель 0,2н н2SO4.
Декантировав всю жидкость с осадка, приступайте к его промыванию. Для этого налейте в стакан 15-20 мл промывной жидкости, перемешайте палочкой содержимое стакана, дайте осадку отстояться и декантируйте жидкость на фильтр. Промывание повторите несколько раз до полного удаления ионов Сl-, т.е. пока собранная в пробирку порция фильтрата не будет давать осадка AgCl (в присутствии AgNO3). Отмыв осадок от примесей Сl-, количественно (без потерь) перенесете его на фильтр. (Это самый ответственный момент в работе). Для этого осадок размешайте в небольшом количестве промывной жидкости. Полученную суспензии осторожно по палочке слейте на фильтр. Обмывая стакан из промывалки маленькими порциями промывной жидкости и сливая ее вместе с частицами осадка на фильтр, старайтесь осадок полней перенести на фильтр. В конце все приставшие к стенке стакана частицы осадка снимайте сложенным кусочком беззольного фильтра, передвигая последний внутрь стакана стеклянной палочкой. Другим кусочком фильтра оботрите палочку и поместите оба кусочка на фильтр. Убедившись, что частиц осадка ни в стакане, ни на палочке не осталось, приступайте к промыванию осадка на фильтре. Последнее удобнее всего делать с помощью промывалки. Струю жидкости из промывалки во избежание разбрызгивания нужно направлять не на центр осадка, а на боковую его поверхность, смывая частицы осадка в самый низ фильтра. Как и в случае декантации, новую порцию жидкости можно вливать тогда, когда предыдущая жидкость стекла полностью. На фильтре осадок промойте дистиллированной водой несколько раз до полного удаления ионов SO42-. Промывание прекращайте, когда собранная в пробирку порция фильтрата перестанет давать осадок сульфата бария при добавлении хлорида бария.
Высушивание и прокаливание осадка Воронку с осадком накройте листом фильтровальной бумаги и поместите в сушильный шкаф (t° = 100-150°). Подсохший фильтр сверните, положите в прокаленный до постоянной массы тигель и поставьте в муфельную печь, прокаливая в ней 30-35 минут. Затем тиглю с осадком дайте остыть в эксикаторе, взвесьте его на аналитических весах. Прокаливание (по 10-15 минут) и взвешивание повторите несколько раз до получения постоянной массы.
При прокаливании с фильтром сульфат бария частично восстанавливается углем до сульфида:
BaSO4 + 2C = BaS + 2CO2
Однако BaS снова окисляется кислородом воздуха:
BaS + 2O2 = BaSO4
Вычисления Результаты всех взвешиваний записывают в лабораторный журнал. Форма записи:
Постоянная масса тигля
Масса тигля с BaSO4 после первого взвешивания
Масса тигля с BaSO4 после второго взвешивания
Постоянная масса тигля с BaSO4
Масса BaSO4
Для определения бария путем взвешивания BaSO4 фактор пересчета равен: 
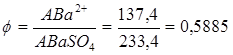
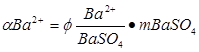
Вопросы для самоподготовки:
1 Какие факторы влияют на полноту осаждения веществ из растворов?
2 При каком значении рН достигается практически полное осаждение Cu(OH)2 и Cd(OH)2?
3 Прозведение растворимости PbS равно ПР= 1×10-29. Вычислить растворимость (моль/л) и концентрацию ионов Pb2+.
4 Из навески 0,4525 г криолита получили 0,0809 г AI2O3. Вычислить процентное содержание Na3AIF6 в криолите.
5 Из навески цемента 1,5000 г получили прокаленный осадок Mg2P2O7 массой 0,2105 г. Сколько процентов MgO содержится в цементе?
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 4293; Нарушение авторских прав?; Мы поможем в написании вашей работы!