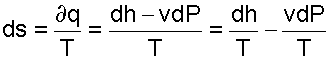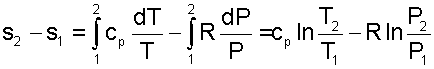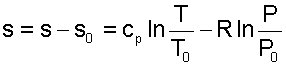КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы
|
|
|
|
ВСТУПИТЕЛЬНОГО КОМПЛЕКСНОГО ЭКЗАМЕНА В МАГИСТРАТУРУ
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
ПО СПЕЦИАЛЬНОСТИ 6М060400 – ФИЗИКА
Направление подготовки – научное и педагогическое
Дисциплины Физика
СҰРАҚТАР
1. Второе начало термодинамики. Цикл Карно. Энтропия. Закон возрастания энтропии. Статистический смысл энтропии. Энтропия идеального газа. Флуктуации.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов, которые могут происходить в термодинамических системах.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом, не доказываемым в рамках классической термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют несколько эквивалентных формулировок второго закона термодинамики:
Постулат Клаузиуса: «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому» [1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатическихи двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником[2].
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно[5]. Пусть тепловая машина состоит из нагревателя с температурой 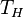 , холодильника с температурой
, холодильника с температурой 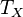 и рабочего тела.
и рабочего тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия). 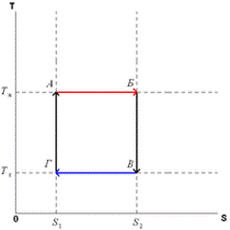
1. Изотермическое расширение (на рис. 1 — процесс A→Б). В начале процесса рабочее тело имеет температуру 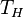 , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты
, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты 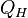 . При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника 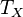 , тело совершает механическую работу, а энтропия остаётся постоянной.
, тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 — процесс В→Г). Рабочее тело, имеющее температуру 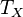 , приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты
, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты 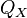 . Над телом совершается работа, его энтропия уменьшается.
. Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — широко используемый в естественных и точных науках термин. Впервые введён в рамках термодинамики как функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. В статистической физике энтропия является мерой вероятности осуществления какого-либо макроскопического состояния. Кроме физики, термин широко употребляется в математике: теории информации и математической статистике. Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы (например, какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации[1][2]). Другой интерпретацией этого понятия является информационная ёмкость системы. С данной интерпретацией связан тот факт, что создатель понятия энтропии в теории информацииКлод Шеннон сначала хотел назвать эту величину информацией. В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру неупорядоченности системы; чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
Математически энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
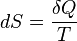 ,
,
где 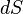 — приращение энтропии;
— приращение энтропии; 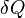 — минимальная теплота, подведённая к системе;
— минимальная теплота, подведённая к системе; 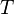 — абсолютная температура процесса.
— абсолютная температура процесса.
Энтропия устанавливает связь между макро- и микро- состояниями. Особенность данной характеристики заключается в том, что это единственная функция в физике, которая показывает направленность процессов. Поскольку энтропия является функцией состояния, то она не зависит от того, как осуществлён переход из одного состояния системы в другое, а определяется только начальным и конечным состояниями системы.
Закон возрастания энтропии. Закон неубывания энтропии: «В изолированной системе энтропия не уменьшается».
Если в некоторый момент времени замкнутая система находится в неравновесном макроскопическом состоянии, то в последующие моменты времени наиболее вероятным следствием будет монотонное возрастание ее энтропии.
| Статистический смысл энтропии |  
|
Посмотрим на энтропию с другой стороны.
Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами.
Состояние же системы, характеризуемое состоянием каждой входящей в систему молекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию. Обозначим W - число микросостояний, соответствующее данному макросостоянию (как правило, W >> 1).
Термодинамической вероятностью или статистическим весом макросостояния W - называется число микросостояний, осуществляющих данное макросостояние (или число перестановок одноименных элементов, при которых сохраняется данное макросостояние).
Термодинамическая вероятность W - максимальна, когда система находится в равновесном состоянии.
В состоянии равновесия и термодинамическая вероятность максимальна, и энтропия максимальна. Из этого можно сделать вывод, что между ними существует связь.
Энтропия S – аддитивная величина: 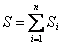 , где , где 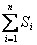 - сумма энтропий тел, входящих в систему.
Вероятность сложного события, есть произведение вероятностей состояний: - сумма энтропий тел, входящих в систему.
Вероятность сложного события, есть произведение вероятностей состояний:
где W 1 – первое состояние; W 2 – второе состояние. Аддитивной величиной является логарифм термодинамической вероятности:
Поэтому Л. Больцман предложил:
где k – коэффициент Больцмана. С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния. Например, в ящике черные и белые шары. Они порознь, есть порядок и W невелика. После встряхивания – шары перемещаются, W увеличивается и энтропия тоже. И сколько бы не встряхивать потом ящик, никогда черные шары не соберутся у одной стенки, а белые у другой, хотя эта вероятность не равна нулю. Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание. Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации. На основе этих рассуждений Р. Клаузиус в 1867 г. и выдвинул гипотезу о тепловой смерти Вселенной (о ней сказано ранее). Л. Больцман один из первых опроверг эту гипотезу и показал, что закон возрастания энтропии – статистический закон, т.е. возможны отклонения. Российские физики Я.Б. Зельдович и И.Д. Новиков так же опровергли эту теорию и показали, что Р. Клаузиус не учел, что Вселенная не стационарна и в будущем не перейдет к одному состоянию, так как она эволюционирует, не остается статичной. Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния. Энтропия идеальных газов Для получения рассчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии
Для идеального газа изменение энтальпии определяется как dh=cPdT, а удельный объем v=RT/P. Подставив данные выражения изменения энталпии и удельного объема в уравнение (4.58), получим уравнение для изменения энтропии идеального газа
Разность энтропий идеального газа в конкретных двух состояниях можно получить интегрированием выражения (4.59)
Воспользовавшись формулой Майера сР=сV+R и уравнением Менделеева-Клапейрона Pv=RT, выражение (4.60) можно записать и через две другие пары термических параметров состояния
Для определения абсолюного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s0=0 при Т0 и Р0, воспользовавшись уравнением (4.60), получим
Выражение (4.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметром состояния, можно определить любой другой параметр состояния газа. Флуктуа́ция (от лат. fluctuatio — колебание) — любое периодическое изменение. В квантовой механике — отклонение от среднего значения случайной величины, характеризующей систему из большого числа хаотично взаимодействующих частиц; такие отклонения вызываются тепловым движением частиц иликвантовомеханическими эффектами. Примером флуктуаций являются флуктуации плотности вещества в окрестностях критических точек, приводящие, в частности, к сильному рассеиванию света и потере прозрачности (опалесценция). Флуктуации, вызванные квантовомеханическими эффектами, присутствуют даже при температуре абсолютного нуля. Они принципиально неустранимы. Пример проявления квантовомеханических флуктуаций — эффект Казимира, а также силы Ван-дер-Ваальса. Непосредственно наблюдаемы квантовомеханические флуктуации для заряда, прошедшего через квантовый точечный контакт — квантовый дробовой шум.
|
2. Бозоны и фермионы. Принцип Паули. Периодическая система элементов Менделеева. Атом в магнитном поле. Эффект Зеемана. Ядерный магнитный резонанс.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 695; Нарушение авторских прав?; Мы поможем в написании вашей работы!
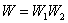 ,
,
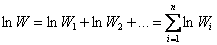 .
.
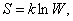 ,
,