
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фермионы и бозоны
|
|
|
|
Частицы с полуцелым спином (например, электрон со спином 1/2) подчиняются статистике Ферми — Дирака и называются фермионами. Два одинаковых фермиона не могут одновременно находиться в одном и том же квантовом состоянии (принцип запрета Паули). Частицы с целым спином (например, фотон) подчиняются статистике Бозе — Эйнштейна. Многие из бозонов могут (и, в известном смысле, «любят») собираться в одном и том же квантовом состоянии, что являетс В физике микромира все т.н. “элементарные” частицы делятся на два класса: фермионы и бозоны. Фермионами называются частицы с полуцелыми значениями спина, бозонами - частицы с целыми значениями спина. Спином называется минимальное значение момента количества движения, которое может иметь частица. Спины и другие моменты импульсов измеряются в единицах  . Для частиц с ненулевой массой покоя спин равен моменту импульса частицы в системе координат, связанной с ней самой. (Значение J спина частиц, указываемое в таблицах, представляет собой максимальное значение проекции вектора момента количества движения на выделенную ось, деленное на
. Для частиц с ненулевой массой покоя спин равен моменту импульса частицы в системе координат, связанной с ней самой. (Значение J спина частиц, указываемое в таблицах, представляет собой максимальное значение проекции вектора момента количества движения на выделенную ось, деленное на  ).
).
Фундаментальными называют частицы, которые по современным представлениям не имеют внутренней структуры. В природе существует 12 фундаментальных фермионов (со спином 1/2 в единицах  )
)
Табл.5.1
| Фундаментальные фермионы | |||||||
| Взаимодействия | Поколения | Заряд Q/e | |||||

| лептоны | νе | νμ | ντ | |||
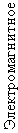
| e | μ | τ | -1 | |||

| кварки | u | c | t | +2/3 | ||
| d | s | b | -1/3 |
12 фундаментальным фермионам соответствуют 12 антифермионов.
Взаимодействие фундаментальных фермионов осуществляется за счет 4 типов взаимодействий: гравитационного, сильного, электромагнитного и слабого. (см. таблицу 1.1. Введения) Гравитационные силы практически не проявляются в физике частиц, например, интенсивность гравитационного взаимодействия двух протонов составляет не более 10-38 интенсивности их электромагнитного взаимодействия. Взаимодействия фундаментальных фермионов осуществляются за счет обмена бозонами - квантами полей.
Сильное взаимодействие осуществляется обменом 8 “цветными” глюонами - нейтральными безмассовыми переносчиками сильного взаимодействия.
Электромагнитное взаимодействие реализуется путем обмена квантами электромагнитного поля, т.е. гамма-квантами.  -кванты имеют нулевую массу. Электромагнитным взаимодействиям подчиняются фундаментальные частицы, занимающие последние три строки в таблице 1, т.е. заряженные лептоны и кварки. Поскольку кварки в свободном состоянии не наблюдаются, а входят в состав адронов, т.е. барионов и мезонов, все адроны подчиняются электромагнитным взаимодействиям.
-кванты имеют нулевую массу. Электромагнитным взаимодействиям подчиняются фундаментальные частицы, занимающие последние три строки в таблице 1, т.е. заряженные лептоны и кварки. Поскольку кварки в свободном состоянии не наблюдаются, а входят в состав адронов, т.е. барионов и мезонов, все адроны подчиняются электромагнитным взаимодействиям.
Слабое взаимодействие (в котором принимают участие все лептоны и все кварки) переносится массивными W и Z бозонами. Существуют как положительные W+ бозоны, так и отрицательные W-; Z -бозоны электрически нейтральны. Массы W и Z бозонов велики - выше 80 ГэВ/с2, следствием больших масс промежуточных бозонов слабого взаимодействия является малая - по сравнению с электромагнитной константой - константа слабого взаимодействия. Глюоны, гамма-квант, W и Z бозоны являются фундаментальными бозонами. Спины фундаментальных бозонов равны 1.
Таким образом, (без учета античастиц) экспериментально установлено существование 12 фундаментальных фермионов и 4 фундаментальных бозонов.
Разделение таблицы 5.1 на поколения оправдано тем фактом, что окружающий нас мир практически полностью построен из частиц т.н. первого поколения (наименее массивных). Частицы второго и, тем более, третьего поколений могут быть обнаружены только при высоких энергиях взаимодействия. Например, t-кварк открыт на ускорителе-коллайдере FNAL, при столкновении протонов и антипротонов с энергиями 1000 ГэВ.
Первые две строки в таблице 5.1 занимают лептоны -фермионы, не принимающие участия в сильных взаимодействиях. Лептонами являются электрически нейтральные нейтрино(и антинейтрино) трех типов - частицы с массами, много меньшими, чем масса электрона. Нейтрино участвуют лишь в слабых взаимодействиях. Вторую строку занимают электрон, мюон и таон - заряженные бесструктурные частицы, участвующие как в слабом, так и электромагнитном взаимодействиях.
Третья и четвертая строки содержат 6 кварков (q) - бесструктурных частиц с дробными значениями электрического заряда. В свободном состоянии эти частицы не наблюдаются, они входят в состав наблюдаемых частиц - адронов.
Частицы, принимающие участие в сильных взаимодействиях, называются адронами (hadrons). Все адроны делятся на два класса: барионы и мезоны. Барионы имеют полуцелый спин (т.е. являются фермионами и подчиняются принципу Паули). Мезоны - частицы с целым значением спина. Спином частицы (собственным моментом количества движения частицы) называется величина, измеряемая в единицах  и численно равная максимальному значению проекции собственного момента количества движения на ось.
и численно равная максимальному значению проекции собственного момента количества движения на ось.
Все адроны - частицы, имеющие внутреннюю структуру. Они состоят из кварков (q) и антикварков. Структура барионов (qqq), мезонов - (q  ). Спины всех кварков равны 1/2.
). Спины всех кварков равны 1/2.
Квантовые числа кварков перечислены в таблице 5.2 (В таблице даны английские термины, обозначающие тип кварков и некоторые из их квантовых чисел, общепринятые в научной литературе)
Табл.5.2
| Квантовые числа кварков | ||||||
| Квантовое число | F l a v o r | |||||
| u | d | c | s | t | b | |
| Q | +2/3 | -1/3 | +2/3 | -1/3 | +2/3 | -1/3 |
| I3 | +1/2 | -1/2 | ||||
| c (charm) | +1 | |||||
| s (strangeness) | -1 | |||||
| t (topness) | +1 | |||||
| b (bottomness) | -1 |
Кроме перечисленных квантовых чисел, кваркам приписывается еще одно - барионный заряд. Поскольку у всех барионов величина барионного заряда равно +1, барионный заряд кварков равен 1/3. Структуры из трех кварков (qqq) - барионы - имеют полуцелый спин и барионный заряд B = 1. К числу барионов относятся протон и нейтрон с кварковыми структурами p = (uud), n = (udd).
Антикварки имеют то же значение спина, что и кварки (т.е. 1/3). Все другие квантовые числа антикварков равны по абсолютной величине и противоположны по знаку квантовым числам кварков. Например, структура протона p = (uud), а антипротона  = (
= (

 ). Его электрический заряд поэтому равен -2/3- 2/3 +1/3= -1, а барионный заряд B(
). Его электрический заряд поэтому равен -2/3- 2/3 +1/3= -1, а барионный заряд B( ) = -1/3 -1/3 -1/3 = -1.
) = -1/3 -1/3 -1/3 = -1.
Частицы, состоящие из кварка и антикварка, называются мезонами, их барионный заряд B = 0. Явления природы, проявляющиеся при невысоких энергиях частиц, могут быть практически полностью объяснены взаимодействием фундаментальных частиц 1-го поколения. 2-е поколение фундаментальных частиц проявляется при более высоких энергиях: первые барионы и мезоны, содержащие наиболее легкий кварк этого поколения - s-кварк были обнаружены в 60-е годы в экспериментах на ускорителях. Это т.н. "странные" частицы. Исследование 3-го поколения фундаментальных частиц возможно только на ускорителях высоких энергий.
Тип кварка (u,d,s,c,b,t) принято называть его ароматом (flavor). Помимо перечисленных в таблицах 5.1 и 5.2 характеристик, кварки обладают еще одним квантовым числом, называемым " цвет "(color). Каждый из 6 ароматов кварков (u,d,c,s,b,t) существует в трех цветовых разновидностях: желтой, синей или красной. Антикварки несут соответствующие цветовые антизаряды: антижелтый, антисиний, антикрасный. Адроны бесцветны, цвета составляющих их кварков в сумме дают отсутствие цвета ("белый" цвет). Переносчики сильного взаимодействия -глюоны- имеют не один, а два цветовых индекса- они связывают между собой “цветные”кварки. Всего имеется не 9, а 8 цветных глюонов, поскольку комбинация жж + сс + кк не имеет цветового заряда (т.е. является "белой"). Свободные кварки и глюоны не существуют: они "заперты" внутри бесцветных адронов.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы, в данном квантовом состоянии, может находиться только один фермион, состояние другого должно отличаться хотя бы одним квантовым числом.
В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения  .
.
Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количествоэлектронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон).
Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1s-орбитали (самой низкой по энергии), при этом у них отличаютсясобственные моменты импульса и третий электрон не может занимать 1s-орбиталь, так как будет нарушен запрет Паули. Поэтому третий электрон занимает 2s-орбиталь (следующая, низшая по энергии, орбиталь после 1s).
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород иногда помещают в 7-ю («короткая» форма) или 17-ю («длинная» форма) группу таблицы[4][5]. Короткая форма таблицы, содержащая восемь групп элементов[6], была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжает приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации[7]. Группа, или семейство, — одна из колонок периодической таблицы. Для групп, как правило, характерны более существенно выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках[11]. Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличенияатомного числа[12]. Впрочем, в некоторых областях таблицы, например — в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные[13][14][15]. Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов[20]. Электронная конфигурация. Организация электронов демонстрирует определенный повторяющийся периодический образец. Электроны занимают последовательность оболочек, которые идентифицируются числами (оболочка 1, оболочка 2 и т. д.), а те, в свою очередь, состоят из подуровней, определяемых литерами s, p, d, f и g. По мере увеличения атомного числа электроны постепенно заполняют эти оболочки; каждый раз, когда электрон впервые занимает новую оболочку, начинается новый период в таблице. Металличность / неметалличность. По мере снижения показателей энергии ионизации, электроотрицательности и энергии сродства к электрону элементы приобретают черты, характерные для металлов, а по мере их возрастания — напротив, для неметаллов[27]. В соответствии с закономерностями для упомянутых характеристик, наиболее ярко выраженные металлы располагаются в начале периода, а неметаллы — в его конце. В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. Сочетание горизонтальных и вертикальных закономерностей придает условной разделительной линии между металлами и неметаллами ступенчатый вид; расположенные вдоль этой линии элементы иногда определяются как металлоиды[28][29].
Атом в магнитном поле. @
Рассмотрим влияние внешнего магнитного поля на движение электронов в атомах  вещества. При внесении атома любого вещества в магнитное поле каждый электрон продолжает двигаться по своей орбите, образуя орбитальный ток. Однако теперь на этот ток, как на рамку с током, действует вращательный момент. Это приводит к тому, что электронная орбита приобретает дополнительное вращение. Частота данного вращения зависит только от величины приложенного поля и отношения заряда электрона к его массе:
вещества. При внесении атома любого вещества в магнитное поле каждый электрон продолжает двигаться по своей орбите, образуя орбитальный ток. Однако теперь на этот ток, как на рамку с током, действует вращательный момент. Это приводит к тому, что электронная орбита приобретает дополнительное вращение. Частота данного вращения зависит только от величины приложенного поля и отношения заряда электрона к его массе: 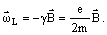 Отсюда следует, что под влиянием внешнего магнитного поля связанные с электронной орбитой векторы
Отсюда следует, что под влиянием внешнего магнитного поля связанные с электронной орбитой векторы 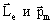 вращаются с той же самой угловой частотой ωL. При этом они описывают круговые конические поверхности с общей вершиной в центре орбиты электрона О вокруг оси, параллельной направлению индукции магнитного поля В (рис.2.3). Частота ωL называется Ларморовой частотой, а возникающее под действием поля дополнительное движение орбиты электрона называется Ларморовой прецессией.
вращаются с той же самой угловой частотой ωL. При этом они описывают круговые конические поверхности с общей вершиной в центре орбиты электрона О вокруг оси, параллельной направлению индукции магнитного поля В (рис.2.3). Частота ωL называется Ларморовой частотой, а возникающее под действием поля дополнительное движение орбиты электрона называется Ларморовой прецессией.
Все вышеизложенное составляет суть теоремы Лармора: единственным результатом влияния магнитного поля на орбиту электрона в атоме является прецессия орбиты и магнитного момента электрона с угловой скоростью ωLвокруг оси, проходящей через ядро атома и параллельной вектору В. Сэр Джозеф Лармор, английский физик и математик, доказал эту теорему в 1895 г., еще до того, как стало известно строение атома. Ларморова частота ωL одинакова для всех электронов, входящих в атом.
Дополнительное движение электронной орбиты обуславливает дополнительное движение электрона, которому соответствует дополнительный круговой ток, направленный в другую сторону по сравнению с орбитальным током(рис. 2.4):
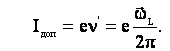
|
 Этот ток создает свой магнитный момент
Этот ток создает свой магнитный момент  . Дополнительный магнитный момент направлен в сторону, противоположную магнитному полю. Он называется индуцированным, или наведенным магнитным моментом. Среднее значение дополнительного магнитного момента:
. Дополнительный магнитный момент направлен в сторону, противоположную магнитному полю. Он называется индуцированным, или наведенным магнитным моментом. Среднее значение дополнительного магнитного момента:

|
Знак «минус» указывает на то, что векторы  и
и  противоположны. Так как электронные микротоки существуют в каждом веществе, то Ларморова прецессия возникает у всех без исключения веществ.
противоположны. Так как электронные микротоки существуют в каждом веществе, то Ларморова прецессия возникает у всех без исключения веществ.
Эффе́кт Зеема́на — расщепление линий атомных спектров в магнитном поле. Назван в честь Питера Зеемана, открывшего эффект в 1896 году.
Эффект обусловлен тем, что в присутствии магнитного поля  электрон, обладающий магнитным моментом
электрон, обладающий магнитным моментом  приобретает дополнительную энергию
приобретает дополнительную энергию  Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу
Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу  и расщеплению атомных спектральных линий.
и расщеплению атомных спектральных линий.
Простым или нормальным эффектом Зеемана называется расщепление спектральных линий на три подуровня, и качественно может быть объяснён классически. Если член взаимодействия 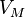 мал (меньше тонкой структуры то есть
мал (меньше тонкой структуры то есть  ), нормальный эффект Зеемана наблюдается:
), нормальный эффект Зеемана наблюдается:
при переходах между синглетными термами (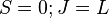 );
);
при переходах между уровнями  и
и 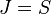 ;
;
при переходах между уровнями  и
и  , поскольку
, поскольку  не расщепляется, а
не расщепляется, а  расщепляется на три подуровня.
расщепляется на три подуровня.
В сильных полях так же наблюдается расщепление на три подуровня, однако это может происходить вследствие эффекта Пашена — Бака (см. далее).
При нормальном эффекте Зеемана расщепление связано с чисто орбитальным или чисто спиновым магнитным моментами. Это наблюдается в синглетах He и в группе щелочноземельных элементов, а также в спектрах Zn, Cd, Hg.
 и
и 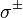 поляризация наблюдаются при изменении проекции магнитного момента на
поляризация наблюдаются при изменении проекции магнитного момента на  и
и 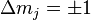 , соответственно.
, соответственно.
Несмотря на то, что Зееман изначально наблюдал в своих экспериментах именно простой эффект, в природе он встречается относительно редко.
Я́дерный магни́тный резона́нс (ЯМР) — резонансное поглощение или излучение электромагнитной энергии веществом, содержащим ядра с ненулевым спином во внешнем магнитном поле, на частоте ν (называемой частотой ЯМР), обусловленное переориентацией магнитных моментов ядер. Одни и те же ядра атомов в различных окружениях в молекуле показывают различные сигналы ЯМР. Отличие такого сигнала ЯМР от сигнала стандартного вещества позволяет определить так называемый химический сдвиг, который обусловлен химическим строением изучаемого вещества. В методиках ЯМР есть много возможностей определять химическое строение веществ, конформации молекул, эффекты взаимного влияния, внутримолекулярные превращения. ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС
(ЯМР)-резонансное поглощение эл.-магн. энергии в веществах, обусловленное ядерным парамагнетизмом; частный случай магнитного резонанса. ЯМР был открыт Ф. Блохом (F. Bloch) и Э. Парселлом (Э. Пёрселл,Е. Purcell) (США) в 1946. ЯМР наблюдается в сильном пост. магн. поле Н 0. при одноврем. воздействии наобразец слабого радиочастотного магн. поля, перпендикулярного Н 0. ЯМР обусловлен наличием у ядерспинов I, соответствующих им моментов кол-ва движения J =  I имагн. моментов [1, 2]
I имагн. моментов [1, 2]
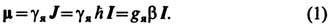
Здесь g я - гиромагн. отношение ядер; g я - ядерный фактор спектроскопич. расщепления (Ландемножитель), имеющий разные значения для разл. ядер; b= е  / 2 Мс- ядерный магнетон (М- масса ядра), к-рый по абс. величине почти в 103 раз меньше магнетона Бора. Спины ядер, обладающих нечётныммассовым числом А (общее число протонов и нейтронов), имеют полуцелые значения, кратные 1/2. Ядра счётным А либо вообще не имеют спина (I =0), если заряд Z (число протонов) чётный, либо имеютцелочисленные значения спина (1, 2, 3 и т. д.).
/ 2 Мс- ядерный магнетон (М- масса ядра), к-рый по абс. величине почти в 103 раз меньше магнетона Бора. Спины ядер, обладающих нечётныммассовым числом А (общее число протонов и нейтронов), имеют полуцелые значения, кратные 1/2. Ядра счётным А либо вообще не имеют спина (I =0), если заряд Z (число протонов) чётный, либо имеютцелочисленные значения спина (1, 2, 3 и т. д.).
Теоретическое описание. В соответствии с классич. представлениями, взаимодействие пост. магн. поля Н 0с магн. моментом ядра m приводит к прецессии последнего вокруг Н 0. счастотой

Резонансная частота w0 зависит от g я; для протонов при H 0 = 104. Э v 0 = w0/2p=42,577 МГц. Для др. ядер втом же магн. поле значения v 0 лежат в диапазоне 1  10 МГц. Радиочастотное магн. поле частоты w0,перпендикулярное Н 0, вызывает изменение угла прецессии, т. е. меняет величину проекции ядерного магн.момента на направление поля Н 0. Это сопровождается резонансным поглощением эл.-магн. энергии иобнаруживается по возникновению эдс индукции в катушке, окружающей образец. Разл. ядрахарактеризуются разными значениями w0, что позволяет их идентифицировать. Однако вследствие того, чтоядерный парамагнетизм слаб (в 105
10 МГц. Радиочастотное магн. поле частоты w0,перпендикулярное Н 0, вызывает изменение угла прецессии, т. е. меняет величину проекции ядерного магн.момента на направление поля Н 0. Это сопровождается резонансным поглощением эл.-магн. энергии иобнаруживается по возникновению эдс индукции в катушке, окружающей образец. Разл. ядрахарактеризуются разными значениями w0, что позволяет их идентифицировать. Однако вследствие того, чтоядерный парамагнетизм слаб (в 105  108 раз слабее электронного парамагнетизма), ЯМР удаётсянаблюдать только на образцах с большим числом исследуемых ядер (обычно
108 раз слабее электронного парамагнетизма), ЯМР удаётсянаблюдать только на образцах с большим числом исследуемых ядер (обычно 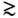 1016) и с помощьювысокочувствительных приборов и спец. методик.
1016) и с помощьювысокочувствительных приборов и спец. методик.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1958; Нарушение авторских прав?; Мы поможем в написании вашей работы!