
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Митохондриальные сигнальные пептиды представляют собой амфипатические аминокислотные
|
|
|
|
8-16
8-13
8-12
8-11
8-7
8-6
8-8
8.2.4. Некоторые белки цитозоля являются короткоживущими [11]
Кроме сигналов, определяющих место их локализации, клеточные белки имеют сигналы, определяющие время их жизни. Белки подвергаются непрерывному обмену: часть их молекул случайным образом деградирует и замещается новыми копиями. Большинство постоянных белков цитозоля существуют относительно долго - несколько дней. Другие, однако, деградируют гораздо быстрее - иногда через несколько минут после их синтеза. К таким белкам относятся ферменты, катализирующие «быстрые» (определяющие скорость) стадии метаболизма; скорости синтеза этих ферментов обычно регулируются в соответствии с внешними условиями, чтобы метаболизм был эффективен. Другие коротко-
живущие белки - это продукты таких клеточных онкогенов, как fos или myc, которые, как полагают, играют важную роль в регуляции роста и деления клетки (см. разд. 13.4.6). Поскольку белки указанных типов непрерывно и быстро разрушаются, их концентрации могут быстро меняться при изменении скорости их синтеза (см. разд. 12.4.7). В большинстве случаев для такой регуляции требуется еще и необычно быстрое обновление мРНК, кодирующих эти белки (см. разд. 10.4.12).
Большинство неправильно свернутых, денатурированных и других аномальных белков тоже быстро деградирует в цитозоле. Обычно они распадаются за несколько минут, тогда как нормальные копии этих же белков сохраняются. Аномальные белки возникают в результате ошибок при синтезе, когда в цепь встраивается неправильная аминокислота, или в результате химических повреждений, таких, как окисление боковых цепей некоторых аминокислот. Разнообразные мутантные формы обыч-
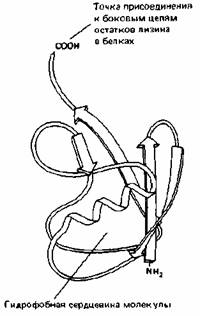
Рис. 8-17. Трехмерная структура убикитина (убиквитина), термостабильного белка, состоящего из 76 аминокислотных остатков.
Присоединение к белку единичной молекулы убикитина является обратимой модификацией, играющей регуляторную роль (см. также рис. 8-15).
Однако добавление к белку разветвленной убикитиновой цепи вызывает его немедленную и полную деградацию (см. рис. 8-18). (По S. Vijay-Kumar, С. Е. Bugg, К. D. Wilkinson, W. J. Cook, Proc. Natl. Acad. Sci. USA 82: 3582-3585, 1985.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ных белков также распознаются в качестве аномальных. Сейчас становится все более очевидным, что и аномальные белки, и белки, генетик запрограммированные на быструю замену, в конечном счете разрушаются в цитозоле при помощи одного и того же протеолитического механизма.
8.2.5. У эукариот избирательная замена белков происходит при помощи убикитин-зависимого протеолиза [12]
Те белки цитозоля, которые должны быстро разрушаться, несут сигналы, включающие ответственный за их деградацию протеолитический механизм. Один из таких сигналов чрезвычайно прост и представляет собой всего лишь первую аминокислоту в полипептидной цепи. Аминокислоты Met, Ser, Thr, Ala, Val, Cys, Gly и Pro, когда они находятся на N-конце, являются стабилизирующими, а остальные 12
аминокислот вызывают протеолитическую атаку. Эти дестабилизирующие аминокислоты практически никогда не встречаются на N-конце стабильных белков цитозоля. Однако они часто присутствуют на N-конце белков, переносимых в другие компартменты, например, в ЭР. Поскольку цитозольный протеолитический механизм отсутствует в полости ЭР или аппарата Гольджи, такие белки в «своих» компартментах обычно являются долгоживущими. Дестабилизирующая N-концевая аминокислота таких нецитозольных белков может служить в клетке для удаления тех копий, которые направляются ошибочно: молекулы, которые нельзя быстро перенести из цитозоля, сразу разрушаются. Подобный же код, состоящий из одного аминокислотного остатка, видимо, существует у бактерий, где также вызывает быструю деградацию специфических белков.
Протеолитический механизм, ответственный за избирательную деградацию белков, сложен и, будучи запущенным, гарантирует полное разрушение белка. У эукариот имеется убикитин-зависимый протеолиз. При таком протеолизе с белком, подлежащим разрушению, связывается множество копий небольшого белка убикитина (рис. 8-17). Связывание убикитина с белком-мишенью катализируется многоферментным комплексом, который, как полагают, присоединяется к N-концу белка, несущему дестабилизирующую N-концевую аминокислоту. Этот фер-
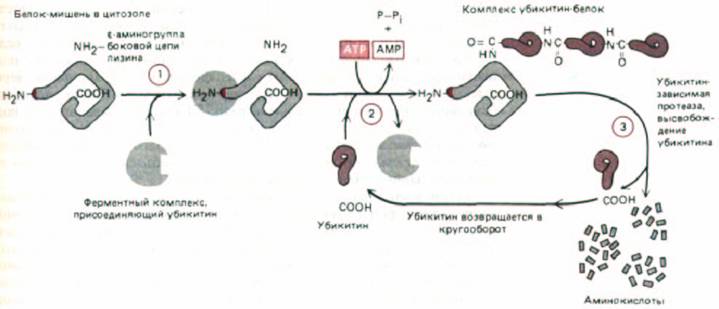
Рис. 8-18. Убикитин-зависимое разрушение белков. Белок-мишень (содержащий «дестабилизирующую» N-концевую аминокислоту, которая служит сигналом для его деградации), узнается ферментным комплексом, присоединяющим убикитин (стадия I). Затем в последовательной серии реакций (стадия 2), молекулы убикитина соединяются друг с другом, образуя разветвленную мультиубикитиновую цепь, присоединенную к.-
аминогруппе в боковой цепи ближайшего остатка лизина в белке. Эта реакция требует подвижности белка-мишени и ускоряется, если белок свернут неправильно. Вслед за этим (стадия 3) большая протеаза, расщепляющая только белки, маркированные разветвленной цепью убикитина, разрезает белок-мишень на множество мелких фрагментов.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ментный комплекс присоединяет молекулу убикитина к ближайшему остатку лизина в полипептиде, а затем добавляет к первой другие молекулы убикитина, формируя разветвленную убикитиновую цепь (рис. 8-18). Вслед за этим большая АТР-зависимая протеаза быстро разрушает такие белки. По-видимому, субстратом для этой протеазы служат только белки, содержащие полиубикитиновые разветвленные цепи, а белки, содержащие одну молекулу убикитина, связанную с лизином (например, гистоны), сохраняются.
8.2.6. Стабильность белка может определяться ферментами, повреждающими его N-конец [13]
Поскольку у цитозольных белков N-концевая аминокислота определяет, будет ли данный белок разрушаться АТР-зависимой протеазой, важно знать, каким образом этот ключевой аминокислотный остаток присоединяется к белку. Вероятно, у белков, генетически запрограммированных на короткое время жизни, дестабилизирующая аминокислота присоединяется к N-концу сразу после окончания синтеза белка. Как обсуждалось в гл. 5 (см. разд. 5.1.10), все белки исходно синтезируются с метионином на N-конце (или формилметионином у бактерий).
Этот метионин, являющийся стабилизирующим остатком, часто удаляется при помощи специфической аминопептидазы вскоре после включения его в белок. Кроме того, аминоацил-тРНК-трансферазы могут добавлять один дестабилизирующий аминокислотный остаток на N-конце белка.
Условия протекания этих реакций изучены еще слабо.
Мишенями для присоединения убикитина и последующей деградации служат в первую очередь денатурированные, неправильно свернутые белки, а также белки, содержащие окисленные или другие аномальные аминокислоты, причем даже в тех случаях, когда на N-конце у них присутствует стабилизирующая аминокислота. Разрушение неправильно свернутых или денатурированных белков может начинаться с распознавания групп гидрофобных аминокислот, которые в нормальной молекуле белка расположены внутри глобулы, а в аномальной могут находиться снаружи (см. разд. 3.3.1). За этим, вероятно, следуют реакции расщепления или модификации белка, в результате которых образуется новый, дестабилизирующий N-концевой остаток. И наконец, благодаря действию убикитин-зависимого прогеолитического механизма, аномальный белок может быть разрушен. При построении любой гипотетической схемы распознавания денатурированных или неправильно свернутых белков главный вопрос состоит в том, как клетка отличает целые аномальные молекулы от множества растущих на рибосомах поли-пептидных цепей, которые могут выглядеть как «неправильно» свернутые. Показано, например, что если к клеткам добавить ингибитор белкового синтеза пуромицин (см. разд. 5.1.15), то незавершенные поли-пептиды быстро распадаются в ходе убикитин-зависимого протеолиза. Возможно, метаболическая стабильность и долго-, и короткоживущих белков во время их синтеза на рибосомах объясняется тем, что они временно защищены аппаратом трансляции.
Установлено, что N-концевой остаток часто бывает устойчив к гидролизу в процессе повторяющихся реакций, используемых в аминов кислотных секвенаторах (см. разд. 4.4.7). Секвенируемые белки обычно ацетилируют по N-концу, который, видимо, становится после этого «заблокированным». Возможно, некоторые белки, модифицированные таким образом, особенно устойчивы к внутриклеточному протеолизу и поэтому являются необычно долгоживущими; к ним относятся многие
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
белки цитоскелета и гистоны, участвующие в укладке ДНК в клеточном ядре. Однако механизм отбора белков, которые должны быть ацетилированы, неизвестен.
8.2.7. Белки теплового шока позволяют предотвратить накопление в клетке белковых агрегатов [14]
Нормальные клетки млекопитающих растут в культуре при 37°С. Если их на короткое время подвергнуть «тепловому шоку», повышая температуру (обычно до 43°С), они начинают синтезировать в большом количестве набор специфических белков. Большинство этих белков
теплового шока образуются и в ответ на другие повреждающие воздействия. Возможно, именно они помогают клетке пережить стрессовые ситуации. Сходные белки синтезируются у Drosophila, дрожжей и даже у бактерий. Изучение последовательностей ДНК показывает, что существует три основных семейства белков теплового шока: с мол. массой 25, 70 и 90 кДа. В нормальных клетках было обнаружено множество очень похожих между собой белков из каждого семейства.
Предполагают, что белки теплового шока помогают переводить в раствор и вновь сворачивать денатурированные или неправильно свернутые белки. Есть у них и другие функции (см. разд. 8.4.4. и 8.6.7). Например, белки из семейства 90 кДа, как было показано, связываются с неактивными формами белков - рецепторов стероидных гормонов и с тирозин-специфическими протеинкиназами, вероятно, таким образом участвуя в регуляции функций этих рецепторов. Лучше всего изучены белки семейства 70 кДа (hsp 70). Эти белки связываются с некоторыми другими белками, а также аномальными белковыми комплексами и агрегатами, от которых потом освобождаются, присоединяя АТР. Было доказано, что они помогают переводить в раствор и заново сворачивать агрегированные или неправильно свернутые белки путем нескольких циклов присоединения и гидролиза АТР. Аномальные белки имеются в любой клетке, но при некоторых воздействиях, например при тепловом шоке, их количество в клетке резко возрастает, и соответственно возникает необходимость в большем количестве белков теплового шока. Оно обеспечивается активацией транскрипции определенных генов. В клетках дрожжей S. cerevisiae, например, имеется восемь hsp 70-генов; некоторые из них транскрибируются при любых условиях, а остальные - только под действием высоких температур или других экстремальных факторов.
Заключение
Цитозоль, составляющий обычно около половины объема эукариотической клетки, представляет собой все внутриклеточное
пространство за вычетом органелл. В цитозоле протекает большинство реакций промежуточного обмена и синтеза белка. Если вновь
синтезированные белки не имеют сигналов для транспорта в органеллы, они остаются в цитозоле. Некоторые из этих белков разрушаются
вскоре после синтеза. Единственная «дестабилизирующая» аминокислота на их N-конце способствует присоединению множества молекул
убикитина к специфическим остаткам лизина в белке-мишени. Затем убикитин- и АТР-зависимая протеаза разрушает такой белок. Дефектные
копии большинства цитозольных белков разрушаются при помощи того же убикитин-зависимого механизма.
Многие белки претерпевают в цитозоле ковалентные модификации. Некоторые из этих модификаций постоянны, другие же, например
фосфорилирование, обратимы и играют валеную роль в регуляции актив-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
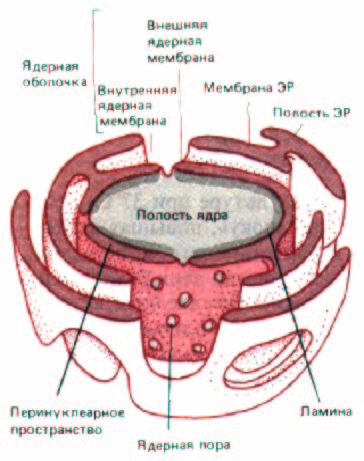
Рис. 8-19. Трехмерная модель двуслойной оболочки, окружающей ядро. Ядерная оболочка пронизана ядерными порами и переходит в эндоплазматический ретикулум.
ности этих белков. К определенным белкам ковалентна присоединяются жирные кислоты. После этого белок, бывший без такой модификации
растворимым, приобретает способность связываться с цитоплазматической поверхностью клеточной мембраны.
8.3. Транспорт белков и РНК в ядро и из ядра [15]
Содержимое клеточного ядра (нуклеоплазма) отделено от цитоплазмы ядерной оболочкой. Ядерная оболочка образована двойной мембраной. Сферическая внутренняя ядерная мембрана содержит специфические белки, выступающие в качестве сайтов связывания ядерной
ламины, которая поддерживает мембрану и контактирует с хромосомами и ядерными РНК. Эта мембрана окружена внешней ядерной мембраной, очень схожей с мембраной эндоплазматического ретикулума, в которую она переходит (рис. 8-19). Внешнюю (наружную) ядерную мембрану можно рассматривать как особую часть мембраны ЭР. Подобно мембранам шероховатого ЭР (см. разд. 8.6.1), внешняя ядерная мембрана усеяна рибосомами, участвующими в синтезе белка. Белки, образованные на этих рибосомах, переносятся в пространство между внешней и внутренней ядерными мембранами (перинуклеарное пространство), которое в свою очередь связано с просветом ЭР (см. рис. 8-19).
Ядро содержит множество белков, необходимых для обеспечения его уникальных функций. Эти белки (к ним относятся гистоны, ДНК-и РНК-полимеразы, белки-регуляторы различных генов и белки, участвующие в процессинге РНК) синтезируются в цитозоле и затем попадают в ядро. Чтобы достигнуть внутреннего пространства ядра (просвета ядра), они должны пройти внешнюю и внутреннюю ядерные мембраны. Этот транспорт происходит избирательно: многие белки, образованные в цитозоле, никогда не попадают в ядро.
8.3.1. Двойную ядерную мембрану пронизывают ядерные поры [16]
У всех эукариот, от дрожжей до человека, ядерная оболочка пронизана ядерными порами. Поры окружены большими кольцевыми структурами, называемыми поровыми комплексами (их внутренний диаметр состав-
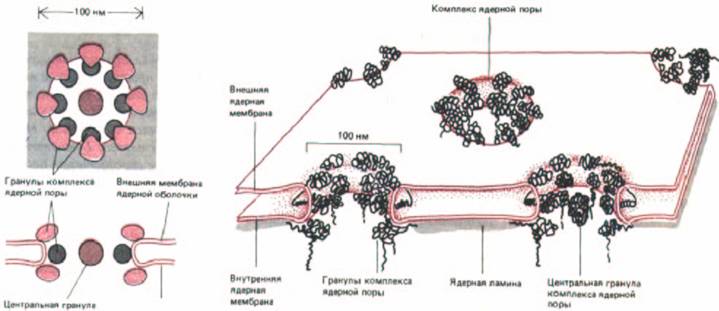
Рис. 8-20. Схема, показывающая расположение ядерных поровых комплексов в ядерной оболочке Вид сверху и поперечное сечение по центру поры (слева). Выделенная цветом «центральная гранула» присутствует в одних порах и отсутствует в других; эти гранулы могут являться частью поры, но не исключено, что это просто крупные частицы, зафиксированные в момент прохождения перового канала. Схема небольшого участка ядерной оболочки (справа).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-21. Электронная микрофотография препарата ядерных поровых комплексов (негативное контрастирование). Каждую пору окружает кольцо из восьми гранул. Размер каждой гранулы примерно равен размеру рибосомы. (С любезного разрешения A. Faberge.)
ляет ≈ 80 нм, а мол. Масса – 50-100 млн. Каждый комплекс образован набором больших белковых гранул, сгруппированных в октагональную структуру (рис. 8-20, А и 8-21). Поровый комплекс пронизывает двойную мембрану, связывая по окружности поры липидный бислой внутренней и внешней мембран в единое целое (рис. 8-20, Б). Несмотря на эту непрерывность, которая должна была бы обеспечивать диффузию компонентов между внешней и внутренней мембранами, они остаются химически различными.
«Дыра» в центре каждого комплекса (ядерная пора) представляет собой водный канал, сквозь который водорастворимые молекулы курсируют между ядром и цитоплазмой. Часто создается впечатление, что это отверстие «закупорено» большой гранулой, которая, как полагают, состоит из вновь синтезированных рибосом или других частиц, видимых в момент переноса в цитоплазму (см. рис. 8-20, Б). Эффективный размер поры в состоянии покоя был определен с помощью эксперимента, в ходе которого в цитозоль вводили различные меченые молекулы неядерного происхождения и измеряли скорости их диффузии в ядро. Оказалось, что малые молекулы (5 кДа и меньше) проникают в ядро с такой скоростью, что ядерную оболочку можно считать для них свободно проницаемой. Концентрация белка с мол. массой 17 кДа выравнивается между цитоплазмой и ядром за 2 мин; для белка с мол. массой 44 кДа это происходит за 30 мин, а глобулярные белки, имеющие свыше 60 кДа, едва ли вообще проникают в ядро. Количественный анализ подобных данных подтверждает, что ядерный поровой комплекс содержит заполненный водой цилиндрический канал диаметром около 9 нм и длиной 15 нм (рис. 8-22). Эти размеры сравнимы с размером беспорядочно расположенных каналов, которые видны на некоторых электронных микрофотографиях.
По-видимому, ядерная оболочка приспособлена к тому, чтобы закрывать содержимое ядерного компартмента (нуклеоплазму) от множества частиц, филаментов и больших молекул, работающих в цитоплазме. Зрелые цитоплазматические рибосомы, например, слишком велики, чтобы проникать через эти 9-нанометровые каналы, поэтому весь белковый синтез ограничивается цитоплазмой. Непонятно только, как же попадают в ядро большие молекулы, которые там необходимы, например, ДНК- и РНК-полимеразы, имеющие мол. массу субъединиц от 100 до 200
кДа? Недавно получены доказательства того, что эти и многие другие ядерные белки взаимодействуют с белками-рецепторами, расположенными на границе ядерных пор, и эти рецепторы активно переносят большие белки в ядро, увеличивая канал поры.
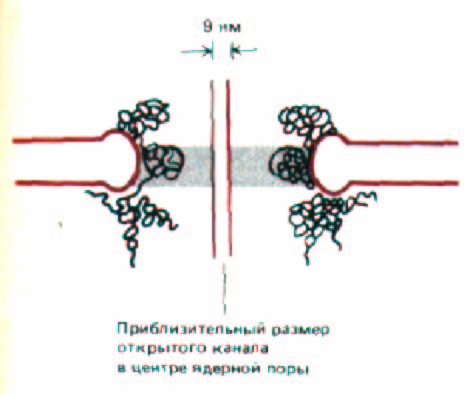
Рис. 8-22. Поперечный разрез ядерной поры (упрощенная схема). Воображаемый цилиндр, изображенный в центре поры, показывает эффективный размер открытого канала, рассчитанный путем измерений транспортируемых частиц. На некоторых электронных микрофотографиях можно различить нити, заполняющие почти все внутреннее пространство поры. Возможно, присутствие этих нитей приводит к уменьшению просвета поры до 9 нм.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-23. Эксперименты, демонстрирующие проникновение избранных белков в ядро через ядерные поры. Нуклеоплазмин представляет собой большой пентамерный белок с отличающимися «головными» и «хвостовыми» доменами. «Головки» можно отрезать от «хвостов» при помощи ограниченного протеолиза. Интактный нуклеоплазмин при введении его в цитоплазму ооцита шпорцевой лягушки быстро накапливается в ядре, несмотря на то, что он слишком велик, чтобы пассивно проникать сквозь маленький канал в центре перового комплекса. По-видимому, сигнал, направляющий импорт этого белка в ядро, расположен в «хвостовом» домене, потому что введенные в цитоплазму ооцита отдельные «хвосты»
переносятся в ядро, а отдельные «головы»-нет. Роль ядерных пор в этом управляемом сигналом переносе показана с помощью электронной микроскопии. Нуклеоплазминовые «хвосты» связывали с частицами коллоидного золота, хорошо видимыми в электронном микроскопе из-за их высокой электроноплотности. Присоединенные нуклеоплазминовые «хвосты» вызывают проникновение частиц коллоидного золота через ядерные поры.
8.3.2. Белки активно проникают в ядро через ядерные поры [17]
Если из ядра экстрагировать белки, а затем с помощью микроинъекции ввести их в цитоплазму, то даже очень крупные белки вновь будут накапливаться в ядре. Одним из наиболее хорошо изученных примеров является мажорный ядерный белок нуклеоплазмин, который можно протеолитически расщепить на «голову» и «хвост». В экспериментах с микроинъекциями «хвостовая» часть проникает в ядро, а «головная»-нет (рис, 8-23). Если «хвосты» связать с частицами коллоидного золота диаметром 20 нм (что гораздо больше внутреннего диаметра находящейся в покое ядерной поры), то частицы золота накапливаются в ядре, их можно видеть в ядерных порах и в процессе транспорта (рис. 8-23 и 8-24).
Следовательно, ядерная пора может «открываться» и пропускать такой большой и чужеродный объект, как частица золота. Похоже, что пора работает подобно клапану, который открывается в ответ на сигнал от достаточно крупного белка. Как все это происходит на молекулярном уровне -
остается загадкой.
Белки, подобные нуклеоплазмину, активно транспортируются через поры, возможно даже оставаясь при этом в свернутом состоянии.
Эксперименты по воссозданию активного ядерного транспорта in vitro подтверждают, что необходимую для этого процесса энергию клетка получает в результате гидролиза АТР.
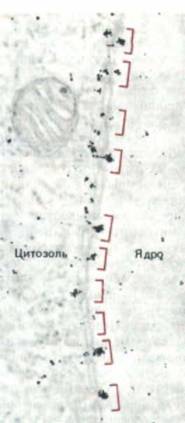
Рис. 8-24. Электронная микрофотография, показывающая прохождение частиц коллоидного золота, покрытых нуклеоплазмином (см. рис. 8-23) в ядро через ядерные поры, локализация которых отмечена цветными скобками. Сходный результат получается, если частицы золота связаны только с хвостовыми частями молекул нуклеоплазмина. Эти частицы больше в диаметре, чем покоящаяся пора. Следовательно, пора должна «открываться», чтобы обеспечить их прохождение в ядро. (По С. Feldherr, E. Kallenbach, N. Schultz, J. Cell Biol. 99: 2216-2222, 1984.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
8.3.3. В ядро активно переносятся только белки, содержащие специальные сигналы [18]
Избирательность ядерного транспорта обеспечивается сигналами ядерного импорта, которые имеются только у ядерных белков. Мы уже говорили о том, что у нуклеоплазмина сигнал такого типа расположен в хвостовой части молекулы. Для некоторых других ядерных белков сигналы ядерного импорта были локализованы более точно с помощью методов генной инженерии. Оказалось, что они могут находиться в любой части молекулы белка, состоят из короткого пептида (обычно от четырех до восьми аминокислотных остатков), обогащенного положительно заряженными аминокислотами лизином и аргинином и обычно содержат пролин. Сигнал такого типа впервые был идентифицирован в белке вируса SV40, так называемом Т-антигене, большом (90 кДа) белке, необходимом для репликации вирусной ДНК в ядре. В норме Т-антиген накапливается в ядре вскоре после его синтеза в цитозоле. Однако замена одной-единственной аминокислоты делает невозможной транспортировку белка и вызывает его накопление в цитоплазме (рис. 8-25). Было высказано предположение, что мутация затрагивает последовательность сигнала ядерного импорта. В ходе дальнейших экспериментов ДНК нормального Т-антигена, кодирующую этот район, состыковали с геном, кодирующим мутантный цитоплазматический белок. При этом была определена минимальная последовательность, обусловливающая способность «гибридного»
белка проникать в ядро. Удалось показать, что сигнал ядерного импорта для Т-антигена представляет собой цепочку из восьми следующих друг за другом аминокислот, расположенных во внутреннем районе его полипептидной цепи (см. табл. 8-3). Дальнейшие эксперименты убедили в том, что эта сигнальная последовательность успешно функционирует и в том случае, если ее синтезировать в виде короткого пептида и химически присоединить к любой случайно выбранной боковой цепи лизина в «цитоплазма-тическом» мутантном белке. Таким образом, локализация сигнала ядерного импорта в белке, по-видимому, не важна.
Механизм транспорта белков в ядро принципиально отличается от механизмов транспорта белков в другие органеллы (которые будут описаны далее). Отличие состоит в том, что транспорт белков в ядро происходит через регулируемые водные поры, а не через одну или более мембран. Более того, когда ядро «разбирается» в митозе, его содержимое перемешивается с цитозолем, и ядерные белки выбрасываются наружу.
Когда ядро собирается вновь, группы хромосом сначала упаковываются в собственные двойные мембраны, прилежащие к ним так плотно, что растворимые белки, включая множество прежних компо-
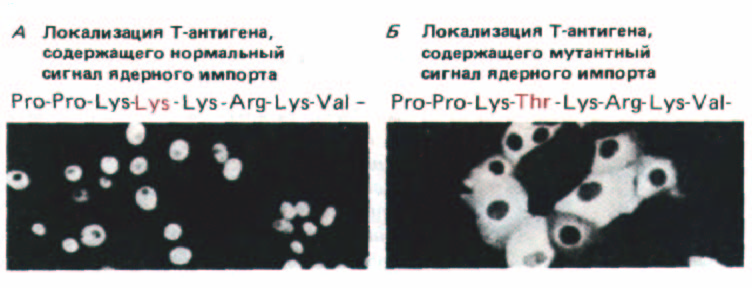
Рис. 8-25. Местонахождение Т-антигена вируса SV40, содержащего или не содержащего сигнальный пептид, определяющий ядерную локализацию.
Т-белок дикого типа содержит приведенную здесь богатую лизином последовательность и импортируется в ядро к месту конечного назначения, что показано с помощью иммунофлуоресцентного окрашивания антителами к Т-антигену (А). Т-антигены с измененным сигнальным пептидом (например, с заменой лизина на треонин) остаются в цитоплазме (Б). (По D. Calderon, В. Roberts, W. Richardson, A. Smith, Cell 39: 499-509, 1984.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
нентов ядра, там «не помещаются». Затем эти заключенные в оболочку хромосомы объединяются, формируя одно ядро, в которое надо транспортировать необходимые белки из цитозоля. Возможно, именно потому, что молекулам ядерного белка предстоит повторный перенос в ядро, сигнальный пептид ядерного импорта не отрезается от них после попадания в ядро. Напротив, когда молекула белка попадает в любую другую мембранную органеллу, она передается от поколения к поколению уже внутри данного компартмента, и ее никогда не приходится транспортировать в него вновь. Поэтому сигнальные пептиды таких молекул удаляются, как только белок переносится внутрь компартмента.
8.3.4. Некоторые РНК покидают ядро через ядерные поры [19]
Ядерная оболочка типичной клетки млекопитающих содержит от 3000 до 4000 пор (примерно 11 пор на 1 мкм2 площади мембраны). Если в клетке синтезируется ДНК, то для упаковки в хроматин вновь синтезированных молекул необходимо каждые 3 минуты переносить из цитоплазмы в ядро около 106 молекул гистонов. Это значит, что каждая пора должна пропускать приблизительно 100 молекул гистонов в минуту. Если клетка быстро растет, то каждая пора должна еще пропускать около трех вновь образованных рибосом из ядра в цитоплазму, поскольку рибосомы формируются в ядре, а функционируют в цитозоле (см. разд. 9.4.17). И это лишь очень небольшая часть всего транспорта, проходящего через ядерные поры.
Особый интерес вызывает механизм экспорта новых субъединиц рибосом. Эти частицы слишком велики (около 15 нм в диаметре), чтобы проникать через 9-нанометровые каналы. Более вероятно, что они проникают сквозь ядерные поры, используя систему активного транспорта.
Полагают, что и молекулы информационной РНК в составе рибонуклеопротеиновых частиц (в комплексе со специальными белками) переносятся из ядра в цитоплазму активно. Если частицы коллоидного золота диаметром 20 нм, подобные тем, что были использованы в экспериментах с нуклеоплазмином (см. рис. 8-24), связать с молекулами малых РНК (тРНК или 5S-PHK) и затем инъецировать в ядро ооцита лягушки, то они быстро переносятся через ядерные поры в цитоплазму. С другой стороны, если их ввести в цитоплазму ооцита, они останутся там. Видимо, помимо рецепторов, узнающих сигналы ядерного импорта, поры содержат один или более рецепторов, распознающих молекулы РНК (или связанные с ними белки), предназначенные для цитозоля; когда эти рецепторы связаны, пора катализирует активный транспорт наружу вместо транспорта внутрь ядра. Заметим, что хотя некоторые белки ядерных пор (включая мажорный мембранный белок с мол. массой 190 кДа) недавно были выделены, до сих пор неизвестно, как именно работает ядерная пора.
Заключение
Ядро заключено в оболочку, состоящую из двух концентрических мемб- ран. Внешняя ядерная мембрана переходит я мембрану ЭР, а
пространст- f во между внешней и внутренней ядерными мембранами переходит в полость ЭР. Молекулы РНК и рибосомы образуются в ядре и
переносятся в цитозолъ, тогда как все белки, функционирующие в ядре, синтезируются в цитозоле и переносятся в ядро. Обмен материалом
между ядром и цитоплазмой происходит через ядерные поры, обеспечивающие прямой путь сквозь внутреннюю и внешнюю ядерные мембраны.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
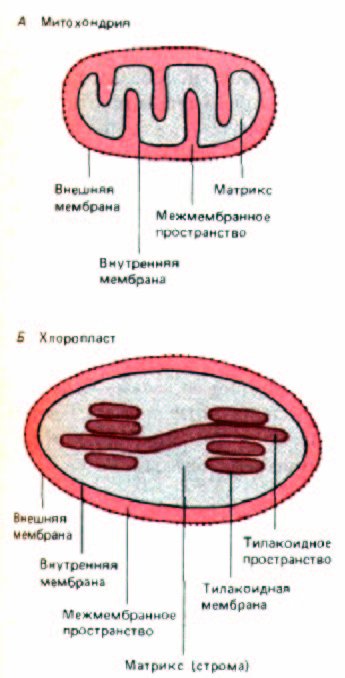
Рис. 8-26. Основные субкомпартменты митохондрий и хлоропластов. Топология хлоропласта может быть получена из топологии митохондрий простым способом: если впячивания внутренней митохондриальной мембраны полностью отпочкуются, то получится компартмент, топологически эквивалентный тилакоидам хлоропластов.
Белки, содержащие сигналы ядерного импорта, активно переносятся в ядро через поры, и узнаются эти белки по коротким, положительно заряженным сигнальным пептидам; поскольку сигнальный пептид не удаляется после переноса, ядерные белки могут быть
перенесены в ядро тогда, когда это требуется при сборке ядра после митоза. Молекулы РНК и, возможно, субъединицы рибосом, активно
переносятся через поры из ядра в цитоплазму.
8.4. Транспорт белков в митохондрии и хлоропласти [20]
Как мы уже хорошо знаем (гл. 7.), митохондрии и хлоропласты представляют собой окруженные двойной мембраной органеллы, специализирующиеся на синтезе АТР - путем транспорта электронов и окислительного фосфорилирования в митохондриях и фотосинтетического фосфорилирования в хлоропластах. Хотя обе органеллы имеют свою собственную ДНК и аппарат белкового синтеза, большинство их белков кодируется клеточной ДНК и поступает из цитозоля. Более того, каждый поступивший в органеллу белок должен достичь определенного субкомпартмента, в котором он функционирует. В митохондриях имеется четыре субкомпартмента: митохондриальный матрикс, внутренняя
мембрана, межмембранное пространство и внешняя мембрана, обращенная к цитозолю (рис. 8-26, А). В хлоропластах, кроме этого, имеется тилакоидная мембрана и тилакоидное пространство (рис. 8-26, Б). Каждый из этих субкомпартментов содержит отличный от других набор белков. Рост митохондрий и хлоропластов возможен за счет импорта цитоплазматических белков, включающего последовательный избирательный перенос белков через одну, две или (в хлоропластах) даже три мембраны.
Те сравнительно немногие белки, которые кодируются собственными геномами этих органелл, расположены в основном во внутренней мембране в митохондриях и в тилакоидной мембране в хлоропластах. Полипептиды, кодируемые геномами этих органелл, обычно образуют субъединицы белковых комплексов, другие компоненты которых кодируются ядерными генами и поступают из цитозоля. Образование таких гибридных белковых агрегатов требует сбалансированности синтеза этих двух типов субъединиц; каким образом координируется синтез белка на рибосомах разных типов, разделенных двумя мембранами, остается загадкой.
последовательности [21]
В изучении биогенеза митохондрий оказалось чрезвычайно полезным использование в качестве объекта дрожжей. В их клетки можно эффективно вводить гибридные гены, кодирующие «смешанные» белки (полученные с помощью методов рекомбинантных ДНК). О механизмах переноса веществ в митохондрии известно гораздо больше, чем о механизмах переноса в хлоропласты. Скорее всего, эти механизмы идентичны, хотя хлоропласты и содержат еще один, самый внутренний мембранный компартмент - тилакоид.
Белки, импортируемые в митохондриальный матрикс, обычно поступают из цитозоля в течение одной-двух минут после их отделения от полирибосом. Эти белки почти всегда несут на N-конце сигнальный пептид длиной от 20 до 80 аминокислотных остатков. После
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-27. Сигнальный пептид для импорта белков в митохондрии. Цитохромоксидаза - это большой, состоящий из многих белков комплекс, расположенный во внутренней митохондриальной мембране, где он функционирует как терминальный фермент в цепи переноса электронов. А.
Первые 12 аминокислот предшественника субъединицы IV этого фермента служат сигнальным пептидом для импорта данной субъединицы в митохондрию. Б. Если на сигнальный пептид, свернутый по всей длине в α-спираль с 3,6 остатками на виток, смотреть сверху, то видно, что положительно заряженные остатки (выделены цветом) сгруппированы с одной стороны спирали, а незаряженные (отмечены прямоугольниками)
собраны с противоположной стороны. Последовательности митохондриальных сигнальных пептидов почти всегда способны образовывать такую амфипатическую спираль. Полагают, что спирали данного типа играют важную роль в переносе белков через митохондриальные мембраны.
поступления белка в митохондрию сигнальный пептид быстро удаляется при помощи специфической протеазы (сигнальной пептидазы) матрикса и затем, вероятно, деградирует в матриксе до аминокислот. Сигнальный пептид может быть исключительно простым. Молекулярно-генетические эксперименты, в которых сигнальную последовательность постепенно укорачивали, показали, что для обеспечения импорта одного митохондриального белка требуется всего 12 аминокислот. Эти 12 остатков можно присоединить к любому митохондриальному белку, и он окажется в митохондриальном матриксе. Физические исследования полных сигнальных пептидов подтверждают, что они могут образовывать амфипатические α-спиральные структуры (рис. 8-27), в которых все положительно заряженные остатки выстроены с одной стороны спирали, а незаряженные гидрофобные остатки уложены с противоположной стороны.
Считается, что внешняя мембрана митохондрий содержит белки-рецепторы, связывающие митохондриальные сигнальные пептиды и тем самым помогающие процессу переноса, однако до сих пор эти гипотетические рецепторы не были как следует охарактеризованы.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1897; Нарушение авторских прав?; Мы поможем в написании вашей работы!