
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Частица, распознающая сигнал, направляет сигнальный пептид ЭР к специфическому рецептору в мембране
|
|
|
|
8-25
8-22
8-21
8.5.2. Все компоненты пероксисом поступают из цитозоля [30]
Пероксисомы можно рассматривать как набор органелл с одинаковой мембраной и различным содержимым. Как отмечалось ранее, в них нет ДНК и рибосом; все их белки кодируются ядерными генами и синтезируются в цитозоле. Как белки мембраны, так и внутренние белки пероксисом поступают из цитозоля после трансляции. Из всех белков пероксисом лучше всего была изучена катализа. Это тетрамерный гем-
содержащий белок, который образуется в цитозоле в виде мономеров, не содержащих гем. Мономеры переносятся в просвет пероксисом и там собираются в тетрамеры в присутствии гема. Хотя каталаза не содержит сигнальной последовательности, отрезаемой после использования, она должна иметь какой-то сигнал, направляющий ее в пероксисому. Согласно последним данным, эту роль, по крайней мере частично, играет специфическая последовательность из трех аминокислот, расположенная вблизи карбоксильного конца многих пероксисомных белков.
Пероксисомы, по-видимому, содержат по крайней мере один уникальный белок, расположенный на обращенной к цитозолю поверхности их мембраны, который работает в качестве рецептора, распознающего сигнал на вносимом белке. Одно время полагали, что мембранная «скорлупа»
пероксисом образуется путем отшнуровывания от ЭР, тогда как их содержимое переносится из цитозоля. В настоящее время имеется ряд данных, доказывающих, что новые пероксисомы всегда возникают из предсуществовавших и формируются путем роста и деления органел-лы, как это описано ранее для митохондрий и хлоропластов (см. разд. 7.5.1). Считают, что все мембранные белки пероксисом, включая предполагаемый рецептор(ы), поступают из цитозоля (рис. 8-34). Вероятно, и липиды, требуемые для построения новой мембраны пероксисом, также доставляются из цитозоля. Возможно, они переносятся от мест их синтеза в мембране ЭР белками, участвующими в обмене фосфолипидов (см. разд. 8.6.15).
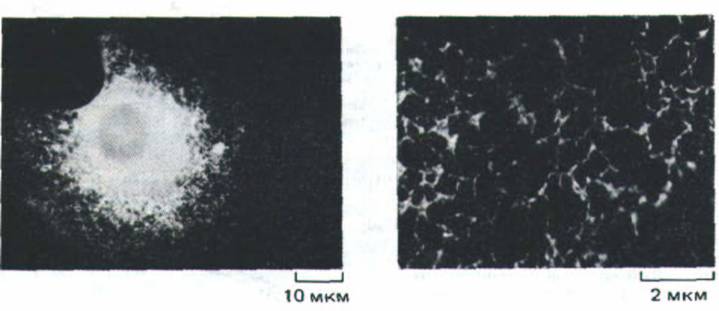
Рис. 8-35. Микрофотография культивируемой клетки млекопитающих. На препарате белки, остающиеся в ЭР, связаны с флуоресцентно меченными антителами. ЭР, подобно сети, распространяется по всей цитоплазме клетки, так что любая область цитозоля прилегает к какой-нибудь части мембраны ЭР. (С любезного разрешения Hugh Pelham.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Заключение
Пероксисомы специализируются на проведении окислительных реакций с использованием молекулярного кислорода. Они вырабатывают
перекись водорода (которая им нужна для окисления), разрушая ее избыток с помощью каталазы. Считают, что, подобно митохондриям и
хлоропластам, пероксисомы являются самовоспроизводящимися органеллами. Однако они не содержат ДНК или рибосом. Полагают, что в их
состав входит уникальный мембранный рецептор, позволяющий вносить внутрь органеллы все белки (включая и сам рецептор) путем
избирательного транспорта из цитозоля.
8.6. Эндоплазматический ретикулум [31]
Все эукариотические клетки имеют Эндоплазматический ретикулум (ЭР). Его чрезвычайно извилистая мембрана обычно составляет более половины общего количества клеточных мембран (см. табл. 8-2). Полагают, что хотя мембрана ЭР имеет многочисленные складки и изгибы, пронизывающие всю цитоплазму, она образует непрерывную поверхность, ограничивающую единое внутреннее пространство. Это внутреннее пространство, называемое полостью ЭР, часто занимает более 10% общего объема клетки (см. табл. 8-1). Полость ЭР отделяется от цитозоля одиночной мембраной (мембраной ЭР), служащей связующим звеном между этими двумя компартментами. Наоборот полости ЭР и каждой цистерны аппарата Гольджи отделены друг от друга двумя мембранами и цитозолем, поэтому транспорт макромолекул между этими органеллами осуществляется при помощи транспортных пузырьков (рис. 8-36), ЭР играет важнейшую роль в клеточных биосинтезах. На мембранах ЭР начинается синтез трансмембранных белков и липидов ЭР, аппарата Гольджи, лизосом и плазматической мембраны. Здесь же производится большинство липидов для мембран митохондрий и пероксисом (см. разд. 8.6.14). Кроме того, все вновь синтезированные белки, независимо от их места назначения (полость ЭР, аппарат Гольджи, лизосомы или внеклеточное пространство), сначала поступают в полость ЭР. Так как ЭР служит отправной точкой для синтеза всех секретируемых белков, он также является местом, где начинается формирование внеклеточного матрикса.

Рис. 8-36. Связь полости ЭР с другими внутриклеточными компартментами, с которыми ЭР контактирует. Просвет ЭР отделен как от ядра, так и от цитозоля всего одной мембраной, тогда как от собранных в стопку цистерн аппарата Гольджи он отделен двумя мембранами. В большинстве случаев ЭР и аппарат Гольджи можно рассматривать как единую функциональную единицу, части которой связаны с помощью транспортных пузырьков.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
8.6.1. Прикрепленные к ЭР рибосомы определяют границы его гранулярных (шероховатых) областей [32]
ЭР удаляет некоторые белки из цитозоля сразу после их синтеза. Это белки двух типов: 1) трансмембранные, которые лишь частично переносятся через мембрану ЭР и остаются заключенными в нее, и 2) водорастворимые, которые полностью переносятся через мембрану ЭР и освобождаются в его полость. Трансмембранные белки предназначены для плазматической мембраны или для мембран других органелл, а водорастворимые направляются либо в полость органелл, либо секретируются. Все эти белки переносятся через мембрану ЭР с помощью одного и того же механизма и одного и того же вида сигнального пептида.
В клетках млекопитающих импорт белков в ЭР начинается еще до того, как полипептидная цепь полностью синтезирована, т. е. он происходит одновременно с трансляцией (котрансляционно). Этим он отличается от импорта в митохондрии, хлоропласты, ядра и пероксисомы, который является посттрансляционным и требует различных сигнальных пептидов. Так как белок переносится внутрь ЭР сразу после образования полипептидной цепи, рибосомы, на которых происходит его синтез, должны быть прикреплены к мембране ЭР. Области ЭР, покрытые связанными с мембраной рибосомами, называют гранулярным (шероховатым) эндоплазматическим ретикулумом (рис. 8-37).
Таким образом, в цитоплазме имеется две пространственно изолированные популяции рибосом. Одни из них (связанные с мембраной
рибосомы) расположены на обращенной к цитоплазме поверхности мембраны ЭР и заняты синтезом белков, которые сразу же переносятся внутрь ЭР. Другие (свободные рибосомы) не прикреплены ни к какой мембране и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭР, то такой сигнал направляег рибосому к мембране ЭР. Поскольку с одной молекулой мРНК может связаться много рибосом, обычно образуется полнрибосома, которая прикрепляется к мембране сразу многими растущими полипептидными цепями. Отдельные рибо-
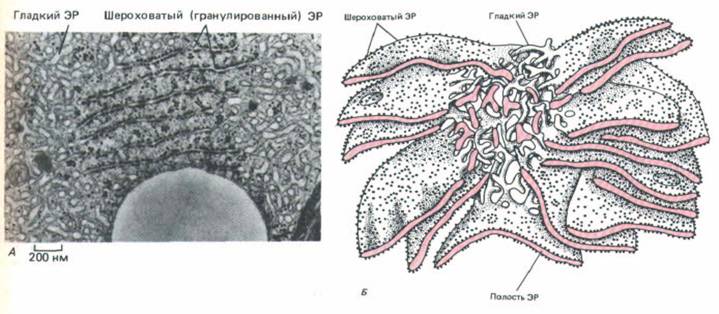
Рис. 8-37. А. Электронная микрофотография, на которой видны значительные различия в морфологии шероховатого и гладкого ЭР.
Показанная здесь клетка Лейдига вырабатывает стероидные гормоны в семеннике и имеет поэтому необычно развитый гладкий ЭР. Видна также часть большой сферической липидной капли. Б. Трехмерная реконструкция участков гладкого и шероховатого ЭР в клетке печени. Шероховатый ЭР получил свое название из-за множества рибосом, расположенных на его цитоплазматической поверхности; он образует поляризованные стопки уплощенных цистерн, каждая из которых имеет просвет (полость) шириной от 20 до 30 нм. С этими цистернами соединены мембраны гладкого ЭР, который представляет собой сеть тонких трубочек диаметром от 30 до 60 нм. Считается, что мембрана ЭР непрерывна и ограничивает единую полость. (А-с любезного разрешения Daniel S. Friend; Б- по R. Krstic, Ultrastructure of the Mammalian Cell. New York: Springer-Verlag, 1979.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
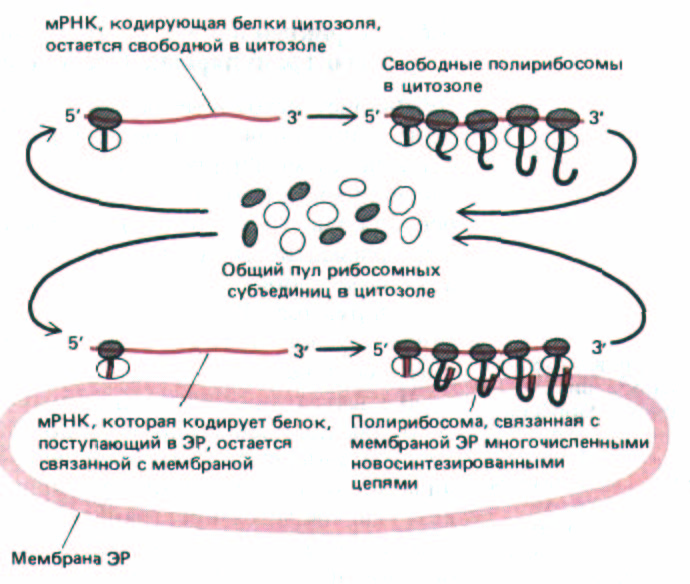
Рис. 8-38. Для синтеза белков цитозоля и белков, поступающих в ЭР, используются одни и те же рибосомы. Если на вновь синтезированной молекуле белка имеется сигнальный пептид, то он направляет связанную с этой молекулой рибосому к мембране ЭР. Молекула мРНК может все время оставаться связанной с мембраной ЭР, тогда как рибосомы, движущиеся вдоль нее, постоянно рециркулиру-ют; в конце каждого цикла белкового синтеза субъединицы рибосом освобождаются и возвращаются в общий пул рибосом в цитозоле.
сомы, связанные с такой молекулой мРНК, могут возвращаться в цито-золь, как только они закончат трансляцию вблизи ее З'-конца. Сама мРНК, однако, стремится остаться связанной с мембраной ЭР через меняющуюся популяцию связанных с мембраной рибосом (рис. 8-38). Напротив, если мРНК кодирует белок, не имеющий сигнального пептида для ЭР, то образующаяся полирибосома остается в цитозоле и ее белковый продукт остается там же. Следовательно, с мембранами шероховатого ЭР связываются только те мРНК, которые кодируют белки, несущие сигнальные пептиды ЭР; те же молекулы мРНК, которые кодируют все остальные белки, остаются в цитозоле. Считают, что отдельные рибосомы случайным образом перемещаются между этими двумя различными популяциями молекул мРНК.
8.6.2. Некоторые специализированные клетки изобилуют гладким ЭР [33]
Участки ЭР, не несущие связанных рибосом, называются гладким ЭР. Как правило, если клетки и содержат настоящий гладкий ЭР, то в очень малых количествах; в действительности большинство областей ЭР частично являются гладкими, а частично-гранулярными. Их называют промежуточным ЭР. Именно от этих районов отшнуровываются транспортные пузырьки, переносящие вновь синтезированные белки в аппарат Гольджи (см. рис. 8-9). Однако существуют специализированные клетки, в которых гладкий ЭР хорошо развит и выполняет особые функции. В частности, гладкий эндоплазматический ретикулум преобладает в клетках, специализирующихся на метаболизме липидов. Например, клетки, синтезирующие стероидные гормоны из холестерола, имеют обширный гладкий ЭР, предназначенный для «расквартирования» ферментов, участвующих в синтезе холестерола и его преобразовании в гормоны (см. рис. 8-37,А).
Еще одним примером клеток, богатых гладким ЭР, являются гепатоциты. Это главное место, где образуются липопротеиновые частицы, предназначенные «на экспорт». Ферменты, синтезирующие липидные компоненты липопротеинов, локализованы на мембранах гладкого ЭР. На этих же мембранах расположены ферменты, катализирующие ряд реакций детоксикации, в результате которых обезвреживаются как лекарственные препараты, так и вредные соединения, образующиеся
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
в процессе метаболизма. Наиболее широко изучены реакции детоксикации, катализируемые ферментами семейства цитохрома Р450. Эти белки используют высокоэнергетические электроны, полученные от NADPH, для присоединения гидроксильных групп к любому из множества потенциально вредных водонерастворимых углеводородов, попадающих в бислой. Другие ферменты на мембране ЭР добавляют затем к этим гидроксильным группам отрицательно заряженные растворимые в воде молекулы (такие, как сульфат или глюкуроновая кислота). После нескольких подобных реакций тот нерастворимый в воде лекарственный препарат (или метаболит), который в противном случае мог бы накапливаться в клеточных мембранах, становится достаточно растворимым, чтобы покинуть клетку и выделиться с мочой. Поскольку один только шероховатый ЭР не может вместить все эти и другие необходимые ферменты, значительная часть мембран гепатоцита в норме представлена гладким ЭР (см. табл. 8-2).
Если в кровоток попадают большие количества некоторых соединений, таких, как фенобарбитал, то в печени в необычно больших количествах синтезируются ферменты детоксикации, и поверхность гладкого ЭР может за несколько дней удвоиться. После удаления лекарственного вещества избыток мембран гладкого ЭР разрушается с помощью лизо-сом (при участии особых образований, называемых аутофагосомами - см. разд. 8.8.3), и через 5 дней гладкий ЭР приобретает нормальный объем. Как регулируются все эти изменения, неизвестно.
Мышечные клетки имеют специализированную, подобную гладкому ЭР, органеллу, называемую саркоплазматическим ретикулумом, которая захватывает из цитозоля Са2+. Основной мембранный белок саркоплазматического ретикулума-Са2+ -АТРаза, накачивающая внутрь ионы Са2 +. Быстрое сокращение и расслабление миофибрилл в каждом цикле мышечного сокращения опосредуется высвобождением Са2+ из саркоплазматического ретикулума и затем повторным захватом его из цитозоля. Захватывающие Са2+ органеллы меньшего объема имеются в большинстве эукариотических клеток, где они высвобождают Са2+ в цитозоль в ответ на внеклеточные сигналы. Раньше считалось, что они являются частью ЭР, но теперь кажется более вероятным, что это самостоятельный мембранный компартмент неизвестного происхождения.
Перейдем теперь к обсуждению двух основных функций ЭР: синтеза и модификации белков и синтеза липидов.
8.6.3. Гранулярные и гладкие области ЭР могут быть разделены центрифугированием [34]
Чтобы изучать функции и биохимию эндоплазматического ретикулума, необходимо сначала отделить его мембраны от других компонентов клетки. На первый взгляд эта задача кажется невыполнимой, поскольку ЭР как бы прослаивает все другие компоненты цитоплазмы (см. рис. 8-35). К счастью, когда ткани или клетки разрушают гомогенизацией, ЭР распадается на множество мелких («100 нм в диаметре)
замкнутых пузырьков, называемых микросомами, которые относительно легко очистить.
Микросомы, полученные из гранулярного (шероховатого) ЭР, усеяны рибосомами и называются шероховатыми микросомами. Рибосомы всегда расположены на их внешней поверхности; это свидетельствует о том, что пространство внутри микросом с биохимической точки зрения эквивалентно полости ЭР (рис. 8-39). В таких гомогенатах обнаруживается также множество пузырьков, сходных по размерам с шероховатыми микросомами, но лишенных рибосом. Такие гладкие
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
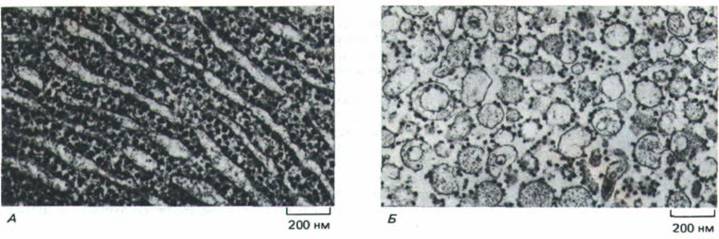
Рис. 8-39. Когда клетки разрушают гомогенизацией, цистерны шероховатого ЭР (А) распадаются на маленькие замкнутые пузырьки, называемые шероховатыми микросомами (Б). Сходным образом, гладкий ЭР распадается на маленькие пузырьки, лишенные рибосом и называемые гладкими микросомами. (А- электронная микрофотография любезно предоставлена Daniel S. Friend; электронная микрофотография любезно предоставлена George Palade.)
микросомы образуются частично из гладких участков ЭР, частично - из фрагментов плазматической мембраны, аппарата Гольджи, эндосом и митохондрий (соотношение их зависит от ткани, из которой получают фракцию микросом). Таким образом, если шероховатые микросомы можно отождествить с шероховатым ЭР, то происхождение гладких микросом нельзя установить с такой же легкостью. Исключением является печень. Так как в гепатоцитах содержится чрезвычайно много гладкого ЭР, источником большинства гладких микросом в гомогенатах печени служит гладкий ЭР.
Рибосомы, содержащие большое количество РНК, придают шероховатым микросомам большую плотность по сравнению с гладкими.
Поэтому гладкие и шероховатые микросомы можно отделить друг от друга путем седиментации их смеси в градиенте плотности сахарозы (рис. 8-
40). Если сравнить шероховатые и гладкие микросомы печени по таким параметрам как ферментативная активность или полипептидный состав, они окажутся чрезвычайно схожими (но не идентичными). Отсюда следует, что большинство компонентов мембраны ЭР может свободно перемещаться между ее гладкими и шероховатыми областями, чего и следовало ожидать, принимая во внимание текучесть и непрерывность мембранной системы.
Поскольку шероховатые микросомы легко поддаются очистке и сохраняют при этом свою функциональную активность, они исключительно полезны для изучения множества процессов, происходящих в ЭР.

Рис. 8-40. Процедура, используемая для выделения шероховатых и гладких микросом из ЭР.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Эти органеллы топологически устроены таким же образом, как и шероховатый ЭР; их поверхность, обращенная в сторону цитоплазмы, легко доступна для ингредиентов, которые можно добавить in vitro. Для биохимика шероховатые микросомы есть не что иное, как уменьшенный вариант шероховатого эндоплазматического ретикулума, способный к синтезу белка, гликозилированию и синтезу липидов.
8.6.4. Гранулярные (шероховатые) участки ЭР содержат белки, ответственные за связывание рибосом [35]
Поскольку мембрана ЭР, как и все мембраны, представляет собой двумерную жидкость, большинство белков и липидов должно свободно распределяться в ней (при отсутствии специальных ограничений) между шероховатыми и гладкими участками. Тем не менее оказалось, что шероховатые микросомы, выделенные из печени, содержат более 20 белков, отсутствующих в гладких микросомах. Этот факт говорит о существовании определенных ограничивающих механизмов. Некоторые из таких «неравновесных» белков мембраны шероховатого ЭР помогают связывать рибосомы, другие, вероятно, определяют ее уплощенную форму (см. рис. 8-37). Неясно, каким образом эти белки удерживаются в мембране: образуют ли они большие двумерные агрегаты или взаимодействуют с сетью структурных белков на той или другой поверхности мембраны ЭР (см. разд. 6.2.10).
Рибосомы шероховатого ЭР удерживаются на мембране частично благодаря растущим полипептидным цепям, продвигающимся сквозь мембрану по мере своего синтеза (см. ниже). Однако, если образование полипептидных цепей прерывается под действием какого-либо ингибитора (например, пуромицина), то рибосомы все равно остаются связанными с мембраной шероховатых микросом. Это сродство значительно повышается в растворах с низкими концентрациями солей. Если в таких условиях смешать очищенные рибосомы с мембранами шероховатых микросом, предварительно лишенными рибосом, то такие «ободранные» мембраны вновь приобретают то же количество рибосом, которое было на них после выделения из клеток. Участок связывания с мембраной находится на большой субъединице рибосомы, но до сих пор еще неясно, с каким из многочисленных белков мембраны шероховатого ЭР связывается рибосома. Установлено, однако, что для связывания рибосом с мембраной ЭР в физиологических условиях требуется дополнительное, более специфическое прикрепление, для которого необходим вновь созданный белок, несущий сигнальный пептид.
8.6.5. Впервые сигнальные пептиды были обнаружены в белках, попадающих в ЭР [36]
Сигнальные пептиды (и способ переноса белков с их помощью) были открыты в начале 70-х гг. при изучении секреторных белков, которые перед переносом в аппарат Гольджи и выведением из клетки, попадают в ЭР. Суть эксперимента заключалась в следующем: мРНК, кодирующую секреторный белок, транслировали в системе in vitro. Когда из этой бесклеточной системы исключали микросомы, синтезированный белок оказывался немного больше, чем нормальный секреторный продукт. Избыток длины можно было объяснить наличием N-концевого лидер-
ного пептида. Однако в присутствии микросом, полученных из шероховатого эндоплазматического ретикулума, белок имел нормальный размер.
Эти результаты были объяснены с помощью сигнальной гипотезы. Она постулирует, что лидерный участок служит сигнальным пептидом, который направляет секреторный белок к мембране ЭР и затем отре-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-41. Упрощенная схема переноса белков в ЭР, согласующаяся с исходной «сигнальной гипотезой». Как только на рибосоме синтезируется сигнальный пептид, он направляет рибосому к белку-рецептору на мембране ЭР. Считается, что по мере синтеза полипептидная цепь переносится через мембрану сквозь белковую пору, связанную с этим рецептором. В процессе трансляции сигнальный пептид отрезается, и сразу после синтеза в просвет ЭР высвобождается зрелый белок.
зается специальной протеазой на мембране ЭР еще до того, как полипептидная цепь будет синтезирована полностью (рис. 8-41).
В соответствии с сигнальной гипотезой секреторный белок в процессе его синтеза in vitro должен проникать в полость микросом. Чтобы убедиться в этом, применили протеазную обработку. Оказалось, что вновь синтезированный белок, образованный в отсутствие микросом, при добавлении протеазы деградирует. Тот же белок, синтезированный в присутствии микросом, остается интактным благодаря защите микросомной мембраны. Когда в бесклеточной системе транслировали белки, лишенные сигнального пептида, эти белки не попадали в микросомы и поэтому оставались чувствительными к протеазной обработке.
Сигнальная гипотеза была проверена и в генетических, и в биохимических экспериментах. Доказана ее справедливость и для растительных, и для животных клеток. Эта гипотеза подтверждается и для случая переноса белков через плазматическую мембрану прокариот.
Более того, N-концевые лидерные пептиды были обнаружены не только у секреторных белков, но и у предшественников белков плазматической мембраны и лизосом, которые также переносятся с помощью ЭР. Как отмечалось ранее, сигнальная роль этих лидерных пептидов была напрямую продемонстрирована с использованием техники рекомбинантных ДНК при присоединении сигнальных последовательностей к белкам, в норме их лишенных; полученные гибридные белки направлялись в ЭР.
Бесклеточная система для переноса белков in vitro обеспечила мощную экспериментальную базу для изучения молекулярного механизма импорта белков в ЭР.
ЭР [37]
В направлении сигнального пептида к мембране ЭР участвуют 1) частица, распознающая сигнал (a signal-recognition particle, SRP), связывающая сигнальный пептид, и ее рецептор, известный также как стыкующий белок. Частицы, распознающие сигнал, были открыты в ходе экспериментов, которые показали, что отмывка микросом в растворах солей уничтожает их способность импортировать секреторные белки. Эту способность можно восстановить, добавляя супернатант, содержащий солевой экстракт. Впоследствии «фактор переноса» был выделен. Он
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
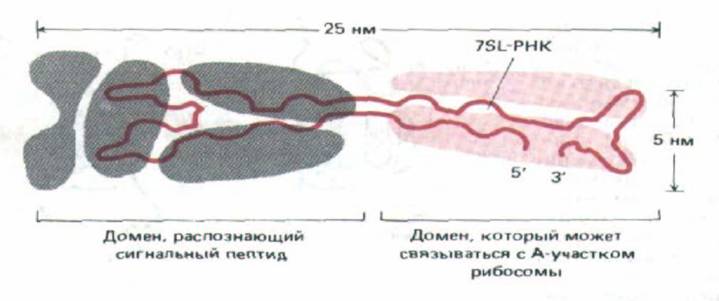
Рис. 8-42. Сильно упрощенная схема частицы, распознающей сигнал (SRP). Она представляет собой вытянутый комплекс, состоящий из шести полипептидных цепей (закрашенные участки) и одной молекулы 7SL-PHK. Один конец этой частицы связывается с рибосомой, а другой-с сигнальным пептидом вновь синтезированной полипеп-тидной цепи. Было сделано предположение, что часть 7SL-PHK может сворачиваться в тРНК-подобную структуру, которая конкурирует в А-участке рибосомы с поступающими аминоацил-тРНК, вызывая, таким образом, паузу в трансляции. (По V. Stegel и P. Walter, Nature 320: W-84, 1986.)
оказался сложной частицей, состоящей из шести различных полипептидных цепей, связанных с одной молекулой 7SL-PHK (рис. 8-42).
Частица, распознающая сигнал, связывается с сигнальным пептидом, как только он «сходит» с рибосомы. Это приводит к временной остановке синтеза белка, а иногда полностью прерывает его. Возникшая пауза в трансляции, вероятно, дает возможность рибосоме связаться с мембраной ЭР до того, как синтез полипептидной цепи будет завершен. Благодаря этому ненужного высвобождения белка в цитозоль не происходит.
SRP состоит из двух групп белков, соединенных единым РНК-каркасом (см. рис. 8-42). В соответствии с одной из моделей, эта частица плотно захватывает рибосому, присоединяясь и к сигнальному пептиду (как только он появляется на большой субъединице рибосомы), и к ри-
босомному участку связывания аминоацил-тРНК. В результате трансляция останавливается, поскольку блокируется связывание следующей аминоацил-тРНК с рибосомой (рис. 8-43).
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором, находящимся на цитоплазматической стороне мембраны шероховатого ЭР. Рецептор, как и сама частица, был вначале идентифицирован in vitro как необходимый компонент для переноса белка в ЭР. Теперь известно, что это интегральный мембранный белок, состоящий из двух цепей. Он взаимодействует с SRP-связанными рибосомами таким образом, что частица меняет свое положение и трансляция возобновляется. Одновременно рибосома связывается с мембраной ЭР, и растущая на ней полипептидная цепь переносится к системе транслокации в мембране. Эта система изучена
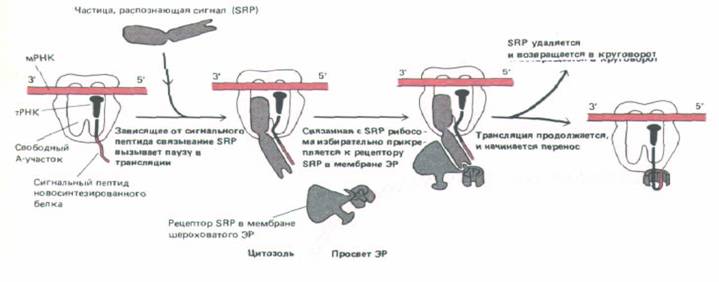
Рис. 8-43. Полагают, что частица, распознающая сигнал, и белок-рецептор SRP действуют согласованно, направляя в ЭР белок с сигнальным пептидом ЭР. SRP связывается с экспонированным сигнальным пептидом и с рибосомой, возможно закрывая А-участок. Поскольку поступление очередной аминоацил-тРНК блокируется, трансляция прерывается. Рецептор SRP в мембране ЭР связывает комплекс SRP-рибосома;
затем, в процессе сложной и плохо изученной реакции, SRP удаляется, и трансляция возобновляется, теперь уже на рибосоме, расположенной на мембране ЭР. Для механизма, с помощью которого полипептидная цепь исходно встраивается в мембрану, необходим еще отдельный трансмембранный белок, который связывается с сигнальным пептидом (рецептор сигнального пептида), а также другие белковые компоненты, вовлеченные в перенос и пока как следует не охарактеризованные.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-44. Одно из представлений о транспорте белка через мембрану. После того, как рецептор распознает N-концевой сигнальный пептид, активируется энергозависимый белковый насос, который проталкивает весь белок сквозь мембрану; при этом полипептидная цепь временно разворачивается. Альтернативная возможность состоит в том, что разворачивание белка происходит с цитозольной стороны мембраны и является АТР-зависимым, а белок направляется сквозь мембрану только за счет энергии, высвобождаемой при обратном сворачивании.
плохо, известно только, что она включает белок-рецептор второго сигнального пептида, отличающийся от SRP (см. рис. 8-43). По-видимому, ее роль заключается в связывании рибосомы, на которой синтезировался сигнальный пептид ЭР, с мембраной ЭР; участвует она и в последующем переносе белка через мембрану.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 3320; Нарушение авторских прав?; Мы поможем в написании вашей работы!