
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общую конформацию трансмембранного белка можно предсказать по положению его гидрофобных
|
|
|
|
8-28
аминокислот [40]
Обычно пептиды, останавливающие перенос белка через мембрану, более гидрофобны, чем стартовые пептиды, однако, если изменить их положение в белке, иногда они могут выполнять роль старт-сигналов. Отсюда следует, что различие между гидрофобными старт- и стоп-пептидами отчасти определяется местом их расположения в полипептиднои цепи. По-видимому, существует механизм, анализирующий развернутую полипептидную цепь на наличие гидрофобных сегментов в том же направлении, в котором синтезируется белок (от NH2- к СООН-концу). Частица, распознающая сигнал, выявляет первый подходящий сегмент и тем самым устанавливает «рамку считывания». Участок полипептиднои цепи между этим старт-сегментом и следующим за ним стоп-сигналом переноса протаскивается сквозь мембрану (см. рис. 8-46). По-видимому, процесс переноса продолжается до тех пор, пока все гидрофобные участки не встроятся в мембрану.
Такой механизм встраивания в мембрану означает, что топография мембранного белка может быть предсказана по его аминокислотной последовательности. Для этого выявляют участки длиной 20-30 аминокислотных остатков с высокой степенью гидрофобности. Они достаточно длинны, чтобы пронизывать мембрану в виде α-спирали, и для их идентификации можно исследовать профиль гидрофобности (рис. 8-47). На рис.
8-48 представлено четыре варианта топологии белка, реконструированной на основе приведенного анализа.
Мембранные белки всегда встраиваются в ЭР со стороны, обращенной к цитозолю. В результате мембрана ЭР оказывается асимметричной: белковые домены, расположенные с одной ее стороны, отличаются от доменов, расположенных с другой стороны. Эта асимметрия сохраняется при многочисленных отпочковываниях и слияниях мембран, с помощью которых белки, синтезированные на ЭР, доставляются к другим клеточным мембранам (см. рис. 8-10).
Когда белки отделяют от мембраны и заключают в искусственные липидные пузырьки, часть из них оказывается в правильной ориентации, а часть в обратной. Поэтому считают, что асимметрия белков, наблюдаемая в клеточных мембранах, целиком обусловлена процессом встраивания белков в мембрану ЭР.

Рис. 8-47. Локализация потенциально гидрофобных (трансмембранных) сегментов полипептиднои цепи с помощью профилей гидрофобности. Свободная энергия, необходимая для переноса последовательных сегментов полипептиднои цепи из неполярного растворителя в воду, рассчитывается по аминокислотному составу с использованием данных по модельным соединениям. Такой расчет делается для сегментов фиксированного размера (обычно около 10 аминокислотных остатков), начиная с каждой последующей аминокислоты в цепи. «Индекс гидрофобности» данного сегмента откладывается по оси Y как функция от его положения в цепи. Положительные значения соответствуют случаю, когда для переноса в воду требуется свободная энергия (т. е. данный сегмент является гидрофобным), а величина пика соответствует количеству требуемой энергии. Пики индекса гидрофобности показывают положение гидрофобных сегментов в аминокислотной последовательности. Здесь приведены два примера: гликофорин имеет единственный трансмембранный гидрофобный домен и один соответствующий ему пик на профиле гидрофобности (А); бактериородопсин содержит семь трансмембранных спиральных участков, которым соответствуют семь пиков на профиле гидрофобности (Б) (С изменениями по D. Eisenberg, Ann. Rev. Biochem. 53: 595-624, 1984.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
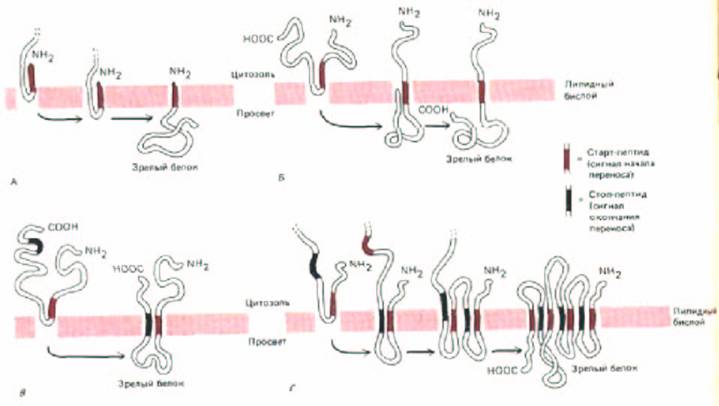
Рис. 8-48. Топология мембранного белка определяется чередованием сигнальных стоп- и старт-псптидов. Во всех приведенных примерах сигнальный пептид не отрезается. Гипотетический белок-переносчик, вероятно, функционирует по схеме, изображенной ранее на рис. 8-46. А.
Когда N-концевой сигнальный пептид не удаляется, а стоп-пептид отсутствует, получается мембранный белок с единственным С-концевым доменом, обращенным в просвет ЭР. Б. Когда сигнальный пептид расположен внутри цепи, образуется белок с N-концевым цитоплазматическим доменом и С-концевым доменом, обращенным в просвет ЭР. Б. Когда за внутренним сигнальным пептидом следует стоп-пептид, то получается мембранный белок с тремя отдельными выступающими из мембраны доменами. Г. Мембранный белок, который пронизывает бислой множество раз, может быть образован путем простого удлинения того же самого процесса, включающего чередование сигнальных пептидов и стоп-пептидов, прерывающих перенос белка через мембрану.
8.6.10. Перенесенные в полость ЭР белки сворачиваются вновь [41]
Сворачивание полипептидных цепей в пространстве ЭР представляет собой особую проблему; с ней не сталкиваются белки, сворачивающиеся в цитозоле. Пространство ЭР заполнено непостоянными для этого компартмента сворачивающимися белками, тогда как в цитозоле в основном присутствуют постоянные для него свернувшиеся белки. Когда белок свернут, он имеет гидрофобную сердцевину (см. разд.
3.3.1), но, пока этого не произошло, гидрофобные остатки, из которых состоит сердцевина, обращены к водной фазе. Если в растворе присутствуют даже в низкой концентрации несвернутые полипептидные цепи, они имеют тенденцию агрегировать друг с другом и с другими белками;
образовавшиеся агрегаты выпадают в осадок. Вполне возможно, что в такой сложной смеси несвернутых белков, которая имеется в полости ЭР, будут образовываться аморфные и гетерогенные преципитаты.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 8-49. Так как восстанавливающие агенты, такие, как трипептид глутатион и маленький белок тиоредоксин, присутствуют в высоких концентрациях в цитозоле и отсутствуют в просвете таких органелл, как ЭР, дисульфидные связи могут образовываться в просвете ЭР, но не в цитозоле. Глутатион и тиоредоксин сохраняются в цитозоле в сильно восстановленной форме при помощи ферментов, которые переносят электроны от NADPH, превращая образующиеся дисульфидные связи в цистеины. Представленная здесь трехмерная структура тиоредоксина Е. coli
была определена в ходе рентгено-структурного анализа. Она содержит два близко расположенных цистеина, показанных здесь связанными дисульфидной связью.
Известно, что время, которое белок проводит в ЭР перед тем, как попасть в аппарат Гольджи, сильно варьирует. Вероятно, эти различия в большой степени зависят от того, как долго данный белок отделяется от преципитата (переходит в растворимое состояние) и свертывается.
В полости ЭР содержится большое количество связывающего белка (В.Р), который, по-видимому, узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. На карбоксильном конце молекулы В.Р имеется сигнальный пептид из четырех аминокислот, благодаря которому белок остается в ЭР (см. табл. 8-3). Существует гипотеза, согласно которой В.Р способствует тому, что неправильно свернутые белки остаются в ЭР (и, следовательно, не попадают в аппарат Гольджи). Возможно, также, что В.Р является одним из катализаторов сворачивания белков. Показано, что этот белок связывает АТР и структурно родствен белкам теплового шока, которые участвуют в импорте белков.
8.6.11. Дисульфидизомераза способствует образованию в полости ЭР правильных дисульфидных связей [42]
В цитозоле содержится смесь восстанавливающих агентов, содержащих SH-группы. Эти вещества предотвращают образование —S—S-
мостиков (дисульфидных связей), поддерживая остатки цистеина в цитозоль-ных белках в восстановленной (—SH) форме (рис. 8-49). В полости ЭР таких восстанавливающих агентов нет, и поэтому —S—S-мостики там образуются. При обилии сворачивающихся белков этот процесс, по-
видимому, иногда идег неправильно. В полости ЭР имеется фермент, помогающий исправлять такие ошибки. Дисульфидизомераза -это белок, который в большом количестве содержится в полости ЭР и прикреплен к внутренней стороне его мембраны. Он имеет тот же сигнал удержания в ЭР, что и В.Р. Механизм действия дисульфидизомеразы состоит в том, что разрезая S—S-связи, она дает белку возможность быстро поменять множество конформаций, пока не будет достигнута конформация с наименьшей общей свободной энергией (рис. 8.50). На этом этапе вновь синтезированный белок сворачивается правильно. Правильная конформация может быть выбрана и случайно, но Дисульфидизомераза значительно ускоряет процесс поиска.

Рис. 8-50. В просвете ЭР фермент дисулъфидизомераза белков многократно разрезает -S-S-связи внутри полипептидной цепи, до тех пор, пока не будет достигнуто их расположение, обладающее минимальной общей свободной энергией. В этих условиях белок сворачивается правильно.
Таким образом фермент облегчает сворачивание вновь синтезированных белков, которые попадают в ЭР.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 996; Нарушение авторских прав?; Мы поможем в написании вашей работы!