
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение правила Вант-Гоффа и уравнения Аррениуса
Влияние температуры на скорость химических реакций.
Скорость химических реакций увеличивается с ростом температуры. Экспериментально установлено, что при увеличении температуры на десять градусов скорость гомогенной реакции возрастает в 2¸4 раза. Эта закономерность называется правилом Вант-Гоффа. Число, показывающее, во сколько раз возрастает константа скорости при повышении температуры на десять градусов, называется температурным коэффициентом константы скорости и обозначается g:
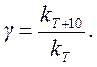 (4.11)
(4.11)
Это правило является приближенным, так как температурный коэффициент сохраняет постоянное значение только в узкой температурной области. Правило Вант-Гоффа можно записать следующим образом:
 или
или  (4.12)
(4.12)
Более точную зависимость константы скорости химической реакции от температуры установил Аррениус, предложивший уравнение
 (4.13)
(4.13)
где Е – энергия активации; k –константа скорости.
Энергией активации называется минимальное избыточное количество энергии молекул (по сравнению со средней), необходимое для их вступления в химическую реакцию.
Определенное интегрирование уравнения (4.13) позволяет получить
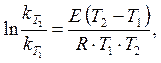 (4.14)
(4.14)
или
 (4.15)
(4.15)
где  и
и  – константы скорости реакции при температуре Т1 и Т2.
– константы скорости реакции при температуре Т1 и Т2.
Понятие «энергия активации» было введено Аррениусом в теории активных столкновений (ТАС), сущность которой состоит в следующем: химическое взаимодействие осуществляется только при взаимодействии активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве определенным образом относительно друг друга.
Зависимость константы скорости от температуры определяется уравнением, которое может быть получено при неопределенном интегрировании уравнения Аррениуса (4.13):
 (4.16)
(4.16)
где k – константа скорости реакции;
А – предэкспоненциальный множитель.
Постоянные А и Е обычно определяют опытным путем по температурной зависимости константы скорости реакции. Для этого уравнение (4.16) можно записать в форме:
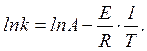 (4.17)
(4.17)
Откладывая на оси ординат ln k, а по оси абсцисс  , получают прямую линию, тангенс угла наклона которой
, получают прямую линию, тангенс угла наклона которой  из этого соотношения находят
из этого соотношения находят  Отрезок, отсекаемый продолжением прямой до пересечения с осью ординат (1/Т = 0), соответствует величине lnA. Отсюда можно рассчитать предэкспоненциальный множитель А.
Отрезок, отсекаемый продолжением прямой до пересечения с осью ординат (1/Т = 0), соответствует величине lnA. Отсюда можно рассчитать предэкспоненциальный множитель А.
П р и м е р 4.6. Для одной и той же реакции определены две константы скорости при двух температурах: 0,00312 мин-1 при 288 К (Т1) и 0,00838 мин-1 при 300 К (Т2). Вычислить энергию активации, температурный коэффициент и константу скорости при температуре 320 К. Расчет константы скорости выполнить двумя методами: по уравнению Вант–Гоффа и с применением уравнения Аррениуса.
|
|
Дата добавления: 2017-01-14; Просмотров: 2511; Нарушение авторских прав?; Мы поможем в написании вашей работы!