
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для медно-цинкового гальванического элемента Якоби-Даниэля
|
|
|
|
 , (3.39)
, (3.39)
где  .
.
При расчете потенциалов электродов и ЭДС гальванических элементов необходимо знать активности потенциалопределяющих ионов. Они зависят от природы электролитов, от их концентрации в растворе и от температуры. Средние ионные активности электролитов 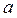 ± рассчитываются по формуле:
± рассчитываются по формуле:
 ± = γ± · m±, (3.40)
± = γ± · m±, (3.40)
где γ ± – средний ионный коэффициент активности, m ± – средняя ионная моляльность.
Средние ионные коэффициенты активности определяют по формуле (3.13), а средние ионные моляльности – по формуле (3.14). Для ряда растворов электролитов коэффициенты активности γ± приведены в табл. 7.6.
В гальванических элементах происходит превращение энергии химических реакций в электрическую энергию. Применение законов термодинамики к электрохимическим системам позволяет рассчитать для равновесного обратимого процесса (химической реакции), протекающего в гальваническом элементе, изменения термодинамических функций и значение константы равновесия.
Электрическая работа гальванического элемента при превращении 1 моля реагента равна количеству переносимого электричества (q = z · F), умноженному на ЭДС (Е, В) элемента:
AP = z · F · E (3.41)
При изобарно-изотермическом обратимом процессе работа совершается за счет убыли энергии Гиббса:
AP = – ∆G, (3.42)
тогда
∆G = – z · F · E, Дж/моль. (3.43)
Изменение энтропии можно определить из соотношения:
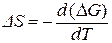 . (3.44)
. (3.44)
После подстановки значения ∆G в выражение (3.44) и дифференцирования получим:
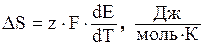 . (3.45)
. (3.45)
Величина 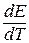 – температурный коэффициент ЭДС. Он показывает изменение ЭДС при изменении температуры на 1 градус. Среднее значение температурного коэффициента может быть найдено по формуле:
– температурный коэффициент ЭДС. Он показывает изменение ЭДС при изменении температуры на 1 градус. Среднее значение температурного коэффициента может быть найдено по формуле:
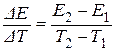 , (3.46)
, (3.46)
где E1 и E2 – ЭДС гальванического элемента при температурах Т1 и Т2, соответственно.
Зависимость ЭДС от температуры может быть описана степенными уравнениями, вид которых устанавливается экспериментально. Если известно уравнение E = f(T), то значение температурного коэффициента 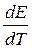 находится путем дифференцирования этого уравнения.
находится путем дифференцирования этого уравнения.
Из химической термодинамики известно, что

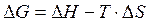 (3.47)
(3.47)
отсюда может быть выражено изменение энтальпии ∆H:
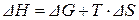 . (3.48)
. (3.48)
После подстановки ∆G (3.43) и ∆S (3.45) в формулу (3.48) получим:
 . (3.49)
. (3.49)
Из уравнения (3.49) следует, что электрическая работа (AP = zFE) может быть представлена соотношением:
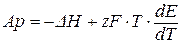 (3.50)
(3.50)
В этом уравнении величина изменения энтальпии ΔH (для химических реакций, протекающих в гальванических элементах ΔH < 0) определяет общую энергию химической реакции, а произведение  (T ·ΔS) характеризует тепловой эффект процесса, то есть ту часть энергии, которая не превращается в электрическую энергию.
(T ·ΔS) характеризует тепловой эффект процесса, то есть ту часть энергии, которая не превращается в электрическую энергию.
Из соотношения (3.50) следует, что электрическая работа равна убыли энтальпии химической реакции только при 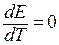 . В случае, если
. В случае, если  (ЭДС уменьшается с ростом температуры), электрическая работа меньше изменения энтальпии химического процесса; и в изотермическом режиме электрохимическая система отдает часть тепловой энергии в окружающую среду или нагревается в условиях тепловой изоляции. При
(ЭДС уменьшается с ростом температуры), электрическая работа меньше изменения энтальпии химического процесса; и в изотермическом режиме электрохимическая система отдает часть тепловой энергии в окружающую среду или нагревается в условиях тепловой изоляции. При 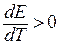 (ЭДС возрастает с ростом температуры) электрическая работа системы больше изменения энтальпии химической реакции. В этом случае недостаток энергии электрохимическая система заимствует из окружающей среды или охлаждается в условиях тепловой изоляции.
(ЭДС возрастает с ростом температуры) электрическая работа системы больше изменения энтальпии химической реакции. В этом случае недостаток энергии электрохимическая система заимствует из окружающей среды или охлаждается в условиях тепловой изоляции.
Для расчета константы равновесия Кa химической реакции, протекающей в гальваническом элементе, используется уравнение изотермы Вант–Гоффа для реакций, протекающих в стандартных условиях (активности потенциалопределяющих ионов или их отношения должны быть равны единице):
 . (3.51)
. (3.51)
Подставив в это выражение уравнение (3.43) для ∆G, получим:
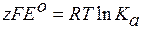 , (3.52)
, (3.52)
где EО – стандартная ЭДС.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1250; Нарушение авторских прав?; Мы поможем в написании вашей работы!