
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет характеристик растворов электролитов
|
|
|
|
Р е ш е н и е
Найдем мольную долю растворенного вещества в данном растворе, для чего воспользуемся уравнением закона Рауля (2.7):
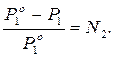
По условию задачи P1 на 2 % ниже  , то есть составляет
, то есть составляет  , тогда:
, тогда:

Отсюда N2 = 0,02.
Для определения моляльности m рассчитаем количество молей растворенного вещества n2, приходящееся в растворе на 1000 г воды. В этом случае m = n2.
Количество молей воды в 1000 г составляет:
n1 = g1/M1 = 1000/ 18 = 55,55 моль.
В соответствии с определением (2.2) запишем выражение для мольной доли растворенного вещества:

в которое подставим значение n1, а вместо n2 – m, и найдем эту величину:

отсюда m = 0,02 · (55,55 + m); 0,98 · m = 1,111;
m = 1,134 моль/1000 г воды.
П р и м е р 2.3. Рассчитать общее давление насыщенного пара над бинарным совершенным раствором при температуре 313 К, состоящим из 200 г дихлорэтана C2H4Cl2 (ДХЭ) и 350 г бензола C6H6 (Б), если давления насыщенного пара над этими чистыми веществами при указанной температуре составляют: РоДХЭ = 2,066·104 Па и  = 2,433·104 Па.
= 2,433·104 Па.
Р е ш е н и е
Молярные массы веществ: MДХЭ = 99 г/моль; MБ = 78 г/моль.
Находим количества молей компонентов в растворе:
nДХЭ = 200/ 99 = 2,020 моль; nБ = 350/ 78 = 4,487 моль;
суммарное количество молей веществ:
nДХЭ + nБ = 2,020 + 4,487 = 6,507 моль.
Рассчитаем мольные доли каждого компонента в растворе:
NДХЭ = 2,020/6,507 = 0,31; NБ = 4,487/6,507 = 0,69.
Давление насыщенного пара над раствором каждого компонента находится по уравнению закона Рауля для совершенных растворов (2.7):


Общее давление рассчитываем по уравнению (2.8):
P = PДХЭ + PБ = 0,640 · 104 + 1,679 · 104 = 2,319 · 104 Па.
П р и м е р 2.4. Рассчитать температуру замерзания (кристаллизации) 1 % раствора серы S в железе Fe, если температура кристаллизации чистого железа составляет 1813 К, а его Ккр. = 101,5 К/моль. Молярная масса серы 32 г/моль.
Р е ш е н и е
Если данный раствор содержит 1 % растворенного вещества, то в 100 г этого раствора содержится 1 г серы (g2) и 99 г железа (g1). Рассчитаем моляльность раствора серы в железе по уравнению (2.5):

Понижение температуры замерзания рассчитываем по уравнению (2.12):
ΔTзам. = Ккр. · m = 101,5 · 0,316 = 32,07 К.
Температура замерзания раствора серы в железе:
Тзам. = Тозам. – ΔTзам = 1813 – 32,07 = 1780,93 К = 1507,73 оС.
П р и м е р 2.5. Рассчитать, какое количество этиленгликоля C2H4(OH)2 необходимо добавить к 500 г воды (g1), чтобы понизить температуру замерзания раствора на 3 градуса. Криоскопическая константа воды Ккр. = 1,86 град/моль. Молярная масса этиленгликоля М2 = 62 г/моль.
Р е ш е н и е
Находим моляльность раствора по уравнению (2.15):

Из формулы (2.5) для расчета моляльности:
 ,
,
выражаем и рассчитываем величину g2:

П р и м е р 2.6. Вычислить молярную массу вещества, если температура замерзания раствора, содержащего 200 г бензола (g1) и 0,4 г исследуемого вещества (g2), на 0,17 К ниже температуры замерзания бензола. Криоскопическая константа бензола Ккр . = 5, 16 К/моль.
Р е ш е н и е
Расчет производим по формуле (2.18) для криоскопии:

П р и м е р 2.7. Вычислить кажущуюся степень диссоциации соли BaCl2 в 3,2%-ном водном растворе, если температура кипения водного раствора равна 100,21 оС. Молярная масса хлорида бария 208 г/моль. Эбулиоскопическая константа воды Кэб . = 0,512 град/моль.
Р е ш е н и е.
Определим моляльность раствора по формуле:

Расчет выполняем для 100г раствора. При указанной массовой концентрации содержание BaCl2 в этом количестве раствора составит 3,2 г (g2), а растворителя – воды g1 = 100 – 3,2 = 96,8 г;
 моль/1000 г воды.
моль/1000 г воды.
ΔTкип = 100,21 – 100 = 0,21 оС (К),
где 100 оС – температура кипения чистого растворителя (воды).
Находим изотонический коэффициент из уравнения (2.17):
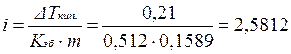 .
.
Степень диссоциации α находим из соотношения (2.10):
 ;
;
для BaCl2 ν = 3, так как при диссоциации одной молекулы этой соли образуются три иона;
 .
.
Найденная степень диссоциации для сильного электролита является кажущейся, а истинная близка к 1.
- ЭЛЕКТРОХИМИЯ
Электролитами называются вещества, которые в растворе или расплаве распадаются на ионы – заряженные частицы (положительные – катионы, отрицательные – анионы). Процесс распада растворенного вещества на ионы самопроизволен и называется электролитической диссоциацией. Диссоциация количественно характеризуется величиной степени диссоциации α, которая представляет собой отношение числа диссоциированных молекул к их общему числу в растворе. По степени диссоциации электролиты делятся на слабые (α £ 0,02) и сильные (α ³ 0,5).
К процессу диссоциации применим закон действующих масс. В случае 1,1-валентного электролита АВ с исходной концентрацией С (г-экв/л) равновесие при диссоциации имеет вид:
АВ ↔ А+ + В-. (3.1)
Выражение для константы равновесия этого процесса КД (константы дисоциации) записывается следующим образом:
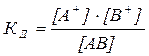 , (3.2)
, (3.2)
где [А+], [В-], [АВ] – равновесные концентрации катионов, анионов и недиссоциированных молекул, которые при степени диссоциации α могут быть выражены следующим образом:
[А+] = α · С, [В-] = α · С, [АВ] = (1 - α) · С, (3.3)
тогда после подстановки этих величин в уравнение (3.2) и сокращения на величину С получим выражение:

 . (3.4)
. (3.4)
Уравнение (3.4) может быть записано с введением понятия разведения. Разведение – это объем раствора данной концентрации, содержащий 1 г-эквивалент растворенного вещества:
 (3.5)
(3.5)
Тогда
 (3.6)
(3.6)
Константа равновесия диссоциации КД – это величина, зависящая от природы электролита, природы растворителя и температуры. Значения КД для электролитов приводятся в справочниках. Уравнения (3.4) и (3.6) известны как математические выражения закона разведения Оствальда.
Уравнение (3.4) может быть использовано для расчета степени диссоциации слабого электролита при заданной концентрации раствора по известной константе диссоциации. В этом случае решается квадратное уравнение:
Сα² + КД α – КД = 0. (3.7)
По найденному значению степени диссоциации и известной концентрации электролита могут быть рассчитаны концентрации ионов в растворе. Концентрации ионов Н+ или ОН – служат для характеристики среды (кислая, нейтральная, щелочная). По ним могут быть рассчитаны водородный рН или гидроксильный показатели рОН:
 , (3.8)
, (3.8)
 . (3.9)
. (3.9)
В случае  (
( г-ион/л) среда нейтральная, при
г-ион/л) среда нейтральная, при  (
( г-ион/л) среда кислая, при
г-ион/л) среда кислая, при 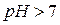 (
( г-ион/л) среда щелочная. Сумма показателей: pH + pOH = 14.
г-ион/л) среда щелочная. Сумма показателей: pH + pOH = 14.
Как указывалось в главе 2, Вант-Гофф ввел понятие об изотоническом коэффициенте i, который показывает, во сколько раз увеличивается число частиц в растворах электролитов за счет диссоциации. Изотонический коэффициент связан со степенью диссоциации α соотношением (2.10).
Растворы электролитов относятся к реальным раствором, так как в них существует взаимодействие между ионами, а также между ионами и молекулами растворителя. Для оценки отклонения свойств реальных растворов от свойств идеальных систем введено понятие термодинамической активности, которое используется в расчетах вместо концентрации и связано с ней коэффициентом термодинамической активности (γ):
 . (3.10)
. (3.10)
Концентрация растворов может выражаться при этом разными способами. Коэффициент термодинамической активности характеризует степень отклонения свойств реальных растворов от свойств идеальных систем. Активность и коэффициент активности зависят от природы, количественного состава растворов и от температуры. Они определяются опытным путем при изучении равновесий в растворах.
Для описания свойств растворов электролитов введено понятие средней активности ионов  :
:
 , (3.11)
, (3.11)
где  – количество катионов и количество анионов, образующихся при диссоциации молекулы электролита;
– количество катионов и количество анионов, образующихся при диссоциации молекулы электролита;  .
.
Средняя ионная активность связана со средней концентрацией (средней моляльностью) раствора m± и средним коэффициентом активности ионов  соотношением:
соотношением:
 . (3.12)
. (3.12)
Каждая из этих средних величин представляет собой среднее геометрическое из соответствующих величин для катионов и анионов:
 (3.13)
(3.13)
 , (3.14)
, (3.14)
где  – моляльность катиона,
– моляльность катиона,  – моляльность аниона, а
– моляльность аниона, а
m – моляльность раствора электролита.
Средние ионные коэффициенты активности могут быть найдены различными экспериментальными методами, а также рассчитаны, например, на основании электростатической теории, которая была создана Дебаем и Гюккелем для описания свойств реальных растворов электролитов.
П р и м е р 3.1. Найти выражения для средних величин: γ± , m± , a±, и aобщ. для электролита KCl, моляльность которого m.
Р е ш е н и е
Электролит KCl относится к валентному типу 1,1.
ν+ = 1, ν- = 1, ν = ν++ν- = 2.
 = =
= =  ;
;
 =
= 
a± = m± · γ± = m · (γ+γ-)1/2;
aобщ.= a±  =
=  =
=  .
.
П р и м е р 3.2. Определить концентрацию гидроксида аммония в воде, при которой он диссоциирован на 1% (α = 0,01). Константа диссоциации КД = 1,79·10 – 5.
Р е ш е н и е
Гидрооксид аммония – 1,1- валентный электролит, диссоциирующий следующим образом:
NH4OH ↔ NH4+ + OH–.
Для решения задачи воспользуемся формулой (3.4):
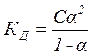 ,
,
откуда, выразив концентрацию С, получаем:
 моль/л (г-экв/л).
моль/л (г-экв/л).
П р и м е р 3.3. Вычислить рН раствора муравьиной кислоты концентрации 0,3 моль/л. Константа диссоциации кислоты 1,772·10-4.
Р е ш е н и е
Муравьиная кислота диссоциирует по схеме:
HCOOH ↔ H+ + HCOO–.
Находим степень диссоциации, решая уравнение (3.7):
Сα² + КД α – КД = 0,
в которое подставляются известные значения С и KД:
0,3 α 2 + 1,772·10-4 α – 1,772·10-4 = 0.
Находим корни этого квадратного уравнения. Физический смысл имеет только положительный корень: α = 0,024.
Так как при диссоциации 1 моля муравьиной кислоты образуется 1 моль ионов водорода, то концентрация ионов водорода:
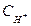 = C · α = 0,3 · 0,024 = 7,2·10-3;
= C · α = 0,3 · 0,024 = 7,2·10-3;
Находим рН раствора:
 = 2,1427 ~ 2,14 < 7 (кислая среда).
= 2,1427 ~ 2,14 < 7 (кислая среда).
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1799; Нарушение авторских прав?; Мы поможем в написании вашей работы!