
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические свойства веществ
|
|
|
|
| Веще-ства | Коли-чество молей, νi |  ,
кДж/моль ,
кДж/моль
|  ,
Дж/(моль·K) ,
Дж/(моль·K)
|  ,
кДж/моль ,
кДж/моль
| Коэффициенты в уравнениях СP = f(T) | ||
| a | b·103 | c΄·10–5 | |||||
| TiO2 | –944,75 | 50,33 | –889,49 | 62,86 | 11,36 | –9,96 | |
| H2 | 130,52 | 27,28 | 3,26 | 0,50 | |||
| Ti | 30,63 | 25,02 | 21,10 | 10,54 | |||
| H2O | –241,81 | 188,72 | –228,61 | 30,00 | 10,71 | 0,33 |
Р е ш е н и е
Находим стандартный тепловой эффект в виде изменения энтальпии по известным теплотам образования по формуле (1.17):
 = [ 2 · 0 + 2 · (– 241,81)] – (– 944,75 + 2 · 0) = 461,13 кДж = 461130 Дж.
= [ 2 · 0 + 2 · (– 241,81)] – (– 944,75 + 2 · 0) = 461,13 кДж = 461130 Дж.
Стандартное изменение энтропии находим по формуле (1.38):

Стандартное изменение энергии Гиббса при Т = 298 К находим по 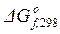 по формуле (1.42):
по формуле (1.42):
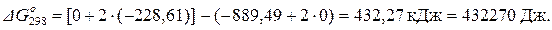 Стандартное изменение энергии Гиббса при Т = 298 К рассчитаем также по уравнению (1.43):
Стандартное изменение энергии Гиббса при Т = 298 К рассчитаем также по уравнению (1.43):
 = 461130 – 298 · 96,70 = 432,31 кДж = 432310 Дж.
= 461130 – 298 · 96,70 = 432,31 кДж = 432310 Дж.
Стандартное изменение энергии Гиббса при Т = 1800 К находим приближенно по формуле (1.46):
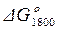 = 461130 – 1800 · 96,70 = 287070 Дж.
= 461130 – 1800 · 96,70 = 287070 Дж.
Так как при температурах 298 К и 1800 К  > 0, то можно сделать вывод, что при этих температурах самопроизвольное протекание данной реакции невозможно (самопроизвольно будет проходить обратная реакция). Следовательно, при расчетных температурах титан не может быть получен из диоксида титана восстановлением водородом.
> 0, то можно сделать вывод, что при этих температурах самопроизвольное протекание данной реакции невозможно (самопроизвольно будет проходить обратная реакция). Следовательно, при расчетных температурах титан не может быть получен из диоксида титана восстановлением водородом.
Точный расчет  выполним по уравнению (1.44), для чего рассчитаем значения
выполним по уравнению (1.44), для чего рассчитаем значения  и
и  по уравнениям (1.25) и (1.39), соответственно, с учетом зависимости этих термодинамических величин и изменения теплоемкости данной химической реакции от температуры. На основе справочных данных, приведенных в табл. 1.10 для реакции взаимодействия диоксида титана с водородом, находим значения коэффициентов Δa, Δb, Δc ΄ уравнения ΔСP = f(T):
по уравнениям (1.25) и (1.39), соответственно, с учетом зависимости этих термодинамических величин и изменения теплоемкости данной химической реакции от температуры. На основе справочных данных, приведенных в табл. 1.10 для реакции взаимодействия диоксида титана с водородом, находим значения коэффициентов Δa, Δb, Δc ΄ уравнения ΔСP = f(T):
Δa = (25,02 + 2 · 30,00) – (62,86 + 2 · 27,28) = – 32,40;
Δb = [(21,10 + 2 ·10,71) – (11,36 + 2 · 3,26)] · 10-3 = 24,64 · 10-3;
Δc΄ = [(10,54 + 2 · 0,33) – (–9,96 + 2 · 0,5)] · 105 = 20,16· 105.
Уравнение зависимости изменения теплоемкости от температуры после подстановки в него найденных значений Δa, Δb, Δc ΄ будет иметь вид:
ΔСP = – 32,40 + 24,64 · 10-3 Т + 20,16 · 105/ T 2.
После подстановки данного уравнения в формулы (1.25) и (1.39) производим расчет изменения энтальпии и изменения энтропии для данной реакции при Т = 1800: 
 Рассчитываем точное значение изменения энергии Гиббса химической реакции при Т = 1800 К по уравнению Гиббса-Гельмгольца (1.44):
Рассчитываем точное значение изменения энергии Гиббса химической реакции при Т = 1800 К по уравнению Гиббса-Гельмгольца (1.44):
 = 456932,9 – 1800 · 86,48 = 301268,9 Дж.
= 456932,9 – 1800 · 86,48 = 301268,9 Дж.
Так как найденные значения изменения энергии Гиббса  > 0 и
> 0 и  > 0, то рассматриваемая реакция не может протекать самопроизвольно при данных условиях.
> 0, то рассматриваемая реакция не может протекать самопроизвольно при данных условиях.
П р и м е р 1.16. Рассчитать изменение энергии Гиббса химической реакции примера 1.15 при Т = 1800 К по методу Темкина–Шварцмана.
Расчет выполняется по формуле (1.47) применительно к рассматриваемой реакции, в которой все участники являются неорганическими веществами:
 Значения коэффициентов Мn берутся из справочника для заданной температуры 1800 К:
Значения коэффициентов Мn берутся из справочника для заданной температуры 1800 К:
Mo = 0,9635; M1 = 0,6265·103; M–2 = 0,3915·10–5.
Величины  ,
,  , значения коэффициентов Δa, Δb, Δc ΄ найдены для данной реакции в примере 1.15.
, значения коэффициентов Δa, Δb, Δc ΄ найдены для данной реакции в примере 1.15.
Находим изменение энергии Гиббса реакции при Т = 1800 К:

|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2464; Нарушение авторских прав?; Мы поможем в написании вашей работы!