
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические потенциалы
|
|
|
|
Р е ш е н и е
Р е ш е н и е
Р е ш е н и е
Р е ш е н и е
Р е ш е н и е
Т1 = 25 + 273 = 298 К; Т2 = 600 + 273 + 873 К.
Расчет производим, подставив в формулу (1.32) уравнение зависимости теплоемкости алюминия от температуры:

П р и м е р 1.9. Рассчитать изменение энтропии при нагревании 1 кг монооксида углерода от температуры 300 К (Т1) до температуры 600 К (Т2), используя среднюю теплоемкость данного вещества в указанном интервале температур, а также с учетом зависимости его теплоемкости от температуры. Необходимые справочные данные о теплоемкостях монооксида углерода приведены в табл. 1.1.
Находим количество молей нагреваемого монооксида углерода (СО):
n = g /M = 1·103/28 = 35,71 молей,
где g – масса диоксида углерода, в г; M = 28 г/моль – молярная масса СО;
Изменение энтропии при нагревании 1 кг газообразного монооксида углерода от температуры 300 К (Т1) до температуры 600 К (Т2), если для расчета используется средняя теплоемкость данного вещества в интервале температур 298-600, рассчитываем по уравнению (1.33):
ΔS =35,71·29,99· ln 600/300 = 742,32 Дж/К.
Точный расчет производим, подставив в формулу (1.32) уравнение зависимости теплоемкости СО от температуры (CP = 28,41 + 4,10· 10-3 Т – 0,46· 105/ T2):
 = 35,71(19,688 + 1,230 – 0,192) = 740,13 Дж/К.
= 35,71(19,688 + 1,230 – 0,192) = 740,13 Дж/К.
П р и м е р 1.10. Рассчитать изменение энтропии при расширении 100 г водорода в вакууме при постоянной температуре, если его объем увеличился в 3 раза.
Так как расширение газа совершается при постоянной температуре, то применим уравнение (1.34):
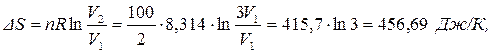
где 2 – молярная масса водорода, г/моль; V1 – начальный объем водорода.
П р и м е р 1.11. Рассчитать изменение энтропии при плавлении 0,5 молей льда при температуре 0 оС (273 К), если теплота плавления ΔHпл = 6025 Дж/моль.
Расчет изменения энтропии при фазовом переходе производим по формуле (1.36) с учетом количества молей (n) плавящегося вещества:
 .
.
П р и м е р 1.12. Рассчитать изменение энтропии при нагревании 0,7 моль моноклинной серы от 25 оС (298 К) до 200 оС (473 К) при давлении 1 атм, если мольные теплоемкости серы (Дж·моль-1·К-1) равны: СP(Sтв) = 23,64; CP (Sж) = 35,73 + 1,17 ·10-3 Т; мольная теплота плавления моноклинной серы ΔHпл = 1446,4 Дж/моль, температура плавления моноклинной серы 119 оС (392 К).
Общее изменение энтропии складывается из изменений энтропий на трех стадиях: 1) при нагревании твердой серы от 298 до температуры плавления 392 К в твердом состоянии (ΔS1); 2) при плавлении серы при температуре 392 К (ΔS2); 3) при нагревании жидкой серы от 392 до 473 К (ΔS3):
ΔS = ΔS1 + ΔS2 + ΔS3.
Для одного моля моноклинной серы:


Для 0,7 молей моноклинной серы изменение энтропии составит:
 ΔS = 16,977 · 0,7 = 11,88 Дж· К-1.
ΔS = 16,977 · 0,7 = 11,88 Дж· К-1.
П р и м е р 1.13. Рассчитать изменение энтропии при превращении 1 моля льда, взятого при 0 оС (273 К), в пар при температуре 100 оС (373 К). Теплота плавления льда ΔHпл = 6025 Дж/моль, теплота испарения воды ΔHисп = 40590 Дж/моль, теплоемкость жидкой воды 75,44 Дж/моль·К.
Р е ш е н и е
Общее изменение энтропии складывается из изменений энтропий на трех стадиях: 1) при плавлении льда при температуре 273 К (ΔS1); 2) при нагревании воды от 273 К до 373 К в жидком состоянии (ΔS2); 3) при испарении воды при температуре 373 К (ΔS3):
ΔS = ΔS1 + ΔS2 + ΔS3.


1.5.2. Расчет изменений энтропии химических реакций
На основе постулата Планка существует возможность расчета абсолютной энтропии, то есть энтропии, отсчитанной от нулевого значения при Т = 0. Если вещество при изменении температуры от 0 К до Т К претерпело ряд фазовых переходов и стадий нагревания в различных фазовых состояниях при P = const, то, основываясь на вышеизложенном (глава 1.2.1), абсолютная энтропия газообразного вещества при температуре Т может быть рассчитана по следующему уравнению:
 (1.37)
(1.37)
В справочных термодинамических таблицах приведены рассчитанные значения абсолютной энтропии веществ в стандартном состоянии – при температуре 298 К и стандартном давлении  . С использованием этих значений может быть рассчитано стандартное изменение энтропии химических реакций, которое равно разности абсолютных энтропий продуктов реакции и абсолютных энтропий исходных веществ с учетом стехиометрических коэффициентов (количества молей):
. С использованием этих значений может быть рассчитано стандартное изменение энтропии химических реакций, которое равно разности абсолютных энтропий продуктов реакции и абсолютных энтропий исходных веществ с учетом стехиометрических коэффициентов (количества молей):
 (1.38)
(1.38)
Изменение энтропии химических реакций при нестандартной температуре при отсутствии фазовых переходов рассчитывают с учетом зависимости  :
:
 (1.39)
(1.39)
где ΔСP – разность изобарных теплоемкостей продуктов реакции и исходных веществ с учетом количества молей реагентов (стехиометрических коэффициентов).
В точных расчетах необходимо учитывать зависимость ΔСР = f(T):
ΔСP = Δa + Δb·T + Δc ·T2 + Δc΄/ T2.
Тогда после интегрирования получим:
 (1.40)
(1.40)
П р и м е р 1.14. Рассчитать стандартное изменение энтропии и изменение энтропии при Т = 500 К реакции, проходящей в газовой фазе:
CH3OH +1,5 O2 = CO2 + 2 H2O.
метанол СH4O
Необходимые справочные данные представлены в табл. 1.8.
Таблица 1.8
Абсолютные энтропии и коэффициенты в уравнениях СP = f(T)
| Вещества | Коли- чество молей νi |  , Дж/моль∙K , Дж/моль∙K
| Коэффициенты в уравнениях СP = f(T) | |||
| a | b·10 3 | c·10 6 | c΄·10–5 | |||
| CH3OH | 239,76 | 15,28 | 105,20 | –31,04 | – | |
| O2 | 1,5 | 205,04 | 31,46 | 3,39 | – | –3,77 |
| CO2 | 213,66 | 44,14 | 9,04 | – | –8,54 | |
| H2O | 188,72 | 30,00 | 10,71 | – | 0,33 |
Стандартное изменение энтропии находим по формуле (1.38):

Для данной химической реакции находим значения коэффициентов Δa, Δb, Δc, Δc ΄ уравнения ΔСP = f(T):
Δa = (44,14 + 2 · 30,00) – (15,28 + 1,5 · 31,46) = 41,67;
Δb = {(9,04 + 2 ·10,71) – (105,20 + 1,5 · 3,39)} · 10-3 = –79,82 · 10–3;
Δc = – (–31,04) · 10–6 = 31,04 · 10–6;
Δc΄ = {(–8,54 + 2 · 0,33) – 1,5 · (–3,77)} · 105 = –2,22· 105.
Уравнение зависимости изменения теплоемкости от температуры после подстановки в него значений Δa, Δb, Δc, Δc ΄ будет иметь вид:
ΔСP = 41,67 – 79,82 · 10-3 Т + 31,04 · 10-6 T2 –2,22· 105/ T2.
Для нахождения изменения энтропии данной химической реакции при температуре 500 К найденные значение ΔSо298 и уравнение ΔСP = f(T) подставляем в формулу (1.39): 

1.5.3. Определение возможности самопроизвольного протекания химических процессов. Расчет изменения энергии Гиббса и изменения энергии Гельмгольца.
Самопроизвольные химические реакции, являясь разновидностью самопроизвольных термодинамических процессов, согласно второму закону термодинамики сопровождаются убылью свободной энергии системы и заканчиваются установлением в системе химического равновесия. В неизолированных (открытых) системах возможность протекания самопроизвольных процессов, их направленность и условия наступления равновесия при соответствующих внешних параметрах определяются с помощью термодинамических потенциалов (табл. 1.9).
Таблица 1.9
| Термодина- мический потенциал | Постоянные величины | Условия самопроизвольного протекания процесса | Условия равновесия |
| U | S = const, V = const | d U < 0 | d U = 0, d2 U >0 |
| H | S = const, P = const | d H < 0 | d H = 0, d2 H >0 |
| F | T = const, V = const | d F < 0 | d F = 0, d2 F >0 |
| G | T = const, P = const | d G < 0 | dG = 0, d2 G >0 |
Наибольшее значение в конкретных термодинамических расчетах имеют энергия Гиббса G (при P = const и T = const – изобарно-изотермический потенциал) и энергия Гельмгольца F (при V = const и T = const – изохорно-изотермический потенциал). Уменьшение энергии Гиббса и энергии Гельмгольца равно максимальной работе, которую может совершить система в соответствующем процессе. При самопроизвольных процессах G и F всегда уменьшаются (dG < 0 и dF < 0, соответственно), а в состоянии равновесия они достигают минимального значения и не изменяются. Условия равновесия при постоянстве соответствующих параметров:
dG = 0 (P, T = const); dF = 0 (V,T = const). (1.41)
Большинство химических и металлургических процеccов происходит при Р = const и T = const. Поэтому ниже рассматриваются методы расчета изменения энергии Гиббса (ΔG) химических реакций. Для того, чтобы рассчитать изменение энергии Гельмгольца (ΔF) при температуре Т, необходимо воспользоваться следующим соотношением:
ΔF = ΔG – Δn · RT, (1.42)
где Δn – изменений числа молей газообразных веществ за счет прохождения химической реакции; R = 8,314 Дж/(моль·К) – универсальная газовая постоянная.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2600; Нарушение авторских прав?; Мы поможем в написании вашей работы!