
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства растворов
|
|
|
|
Р е ш е н и е
Р е ш е н и е
Р е ш е н и е
Термодинамические свойства веществ
| Вещества | Количество молей νi |  ,
кДж/моль ,
кДж/моль
|  ,
Дж/(моль·К) ,
Дж/(моль·К)
|
| Al2O3 | –1675,69 | 50,92 | |
| SO3 | –395,85 | 256,69 | |
| Al2(SO4)3 | –3441,80 | 239,20 |
Находим стандартный тепловой эффект в виде изменения энтальпии по известным теплотам образования по формуле (1.17):
ΔНо298 = –3441,80 – (–1675,69 + 3 · (–395,85)) = –578,56 кДж.
Стандартное изменение энтропии находим по формуле (1.38):
ΔSо298 
Стандартное изменение энергии Гиббса при Т = 298 К рассчитаем по уравнению (1.43):
ΔGо298 = –578,56 · 103 – 298 · (– 581,79) = – 405186,6 Дж.
Расчет КP производится по уравнениям (1.62):

Высокое значение константы равновесия свидетельствует о том, что равновесие практически полностью смещено в сторону конечных продуктов, и данная реакция по сути является необратимой.
П р и м е р 1.19. Рассчитать константы равновесия для химической реакции примера 1.15:
TiO2 + 2H2 = Ti + 2H2O.
кр. газ кр. газ
при температурах 298 К и 1800 К. Записать закон действующих масс для данной гетерогенной реакции.
Расчет производится по уравнениям (1.62), в которые подставляют значения ΔGоТ (пример 1.16), соответствующие температурам, для которых выполняется расчет:






Закон действующих масс для данной гетерогенной реакции записывается только через равновесные парциальные давления газообразных веществ (оксид титана и титан находятся в твердом состоянии):

Расчет показал, что с увеличением температуры константа равновесия увеличилась (данная реакция является эндотермической). Однако и при стандартной температуре, и при температуре 1800 К константа равновесия << 1, то есть при данных температурах равновесие смещено в сторону исходных реагентов (реакция практически не идет).
П р и м е р 1.20. Определить, в каком направлении будет протекать при температуре 873 К химическая реакция
COCl2 ↔ CO + Cl2
при следующих заданных значениях неравновесных парциальных давлений компонентов (Н/м2), находящихся в газовой фазе:  = 1,048·105;
= 1,048·105;  = 3,039·105;
= 3,039·105;  = 3,039·105. Константа равновесия KP при данной температуре равна 5,833·105 Н/м2.
= 3,039·105. Константа равновесия KP при данной температуре равна 5,833·105 Н/м2.
Константа равновесия для данной реакции:
 .
.
Проводим расчет изменения энергии Гиббса по уравнению (1.60):
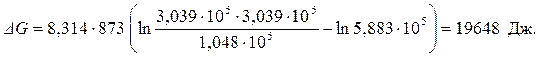
Так как для данной реакции ΔG > 0, то при указанных исходных значениях неравновесных парциальных давлений процесс возможен только в обратном направлении.
1.7. Фазовые равновесия в однокомпонентных системах. Уравнение Клапейрона–Клаузиуса и его применение для расчета теплоты испарения, давления насыщенного пара и температуры кипения
Фазовые равновесия в однокомпонентных системах – это равновесия в гетерогенных системах, в которых протекают процессы перехода компонента из одной фазы в другую.
В однокомпонентных системах различают следующие фазовые переходы:
жидкость ↔ пар (испарение и конденсация);
тв. вещество ↔ пар (возгонка и сублимация);
тв. вещество ↔ жидкость (плавление и кристаллизация);
тв. вещество ↔ тв. вещество (полиморфные превращения).
Фазовые переходы сопровождаются тепловыми эффектами и происходят при определенных температурах (Т). Температурой фазового перехода называется температура, при которой соответствующие фазы находятся в равновесии. Эта температура зависит от внешнего давления (Р). Взаимосвязь Р и Т при равновесии между двумя фазами описывается уравнением Клапейрона–Клаузиуса:
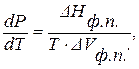 (1.65)
(1.65)
где P и T – давление и температура при фазовом переходе;
ΔHф.п. – изменение энтальпии 1 моля вещества при фазовом переходе (мольный тепловой эффект фазового перехода при P = const);
ΔVф.п. – разность мольных объемов фаз, находящихся в равновесии.
Для процесса испарения и возгонки уравнение (1.65) может быть преобразовано и имеет вид:
 (1.66)
(1.66)
где ΔHф.п . – изменение энтальпии 1 моля вещества при испарении (теплота испарения) или возгонке (теплота возгонки).
В настоящем пособии рассматривается применение уравнения (1.66) для процесса испарения.
Пар, находящийся в динамическом равновесии с жидкостью, из которой он образовался, называется насыщенным паром, а давление, которое оказывает пар, находящийся в равновесии с жидкостью, на поверхность жидкости и стенки сосуда называется давлением насыщенного пара. Температура кипения – это температура перехода вещества из жидкого состояния в парообразное, при которой давление насыщенного пара жидкости равняется внешнему давлению. При кипении испарение происходит по всему объему, а не только с поверхности жидкости
Уравнение Клапейрона–Клаузиуса позволяет рассчитывать теплоты испарения индивидуальных веществ, давление их насыщенного пара при различных температурах, температуры кипения веществ при различных давлениях.
Для расчетов применяется интегральная форма уравнения Клапейрона–Клаузиуса. В небольшом интервале температур DНисп можно считать постоянной. В точных расчетах необходимо учитывать зависимость теплоты испарения от температуры. Интегрирование уравнения Клапейрона-Клаузиуса в пределах от Т1 до Т2, которым соответствуют давления Р1 и Р2, при постоянном значении DНисп позволяет получить уравнения:
 , (1.67)
, (1.67)
 . ( 1.68)
. ( 1.68)
Уравнение (1.68) может быть использовано для расчета DНисп, если известны давления насыщенного пара при двух температурах:

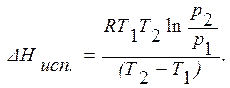 (1.69)
(1.69)
Из уравнений (1.67) и (1.68) можно по известной теплоте испарения и данных о давлении насыщенного пара при одной температуре рассчитывать давление насыщенного пара при другой температуре или температуру кипения при заданном внешнем давлении.
При неопределенном интегрировании уравнения Клапейрона-Клаузиуса получим:
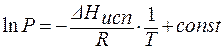 . (1.70)
. (1.70)
Обозначим величину  А, а константу интегрирования В. Тогда
А, а константу интегрирования В. Тогда
 . (1.71)
. (1.71)
Уравнение (1.71) позволяет вычислить давление насыщенного пара над жидкостью при любой температуре, если известны константы А и В, которые определяют на основе экспериментальных данных аналитическим или графическим методом по найденным экспериментально значениям температур кипения, по крайней мере, при двух давлениях. Найденное значение константы А может быть использовано для расчета теплоты испарения:
DНисп.= R × A (1.72)
В соответствии с эмпирическим правиломТрутона мольная теплота испарения неполярных жидкостей (Дж/моль) связана с их температурой кипения при атмосферном давлении Токип ( К) соотношением:
 . (1.73)
. (1.73)
Это соотношение может быть использовано для расчета теплоты испарения неполярных жидкостей:
DHисп.=89,12 × Токип ..(1.74)
Сопоставление найденных на основе экспериментальных данных значений теплот испарений с рассчитанными значениями DHисп по правилу Трутона для данных жидкостей позволяет оценивать их полярность.
П р и м е р 1.21. Зависимость давления пара (мм рт. ст.) от температуры для жидкого металлического цинка выражается уравнением

Вычислить теплоту испарения цинка при температуре плавления (692,7 К).
Р е ш е н и е
Теплоту испарения цинка при температуре 692,7 К рассчитываем по уравнению (1.66), в котором ΔHф.п. = ΔHисп.. Уравнение преобразуем к следующему виду:

Дифференцируя приведенное в условии задачи уравнение зависимости давления пара жидкого металлического цинка от температуры, получаем:

Подставляя полученное выражение в формулу для расчета теплоты испарения, получим:


П р и м е р 1.22. Температура кипения метилового спирта равна 34,7 оС при давлении 200 мм рт. ст. и 49,9 оС при давлении 400 мм рт. ст. Рассчитать теплоту испарения и температуру кипения метилового спирта при нормальном давлении (760 мм рт. ст.).
Запишем исходные данные, присваивая параметрам соответствующие индексы и переводя температуру в градусы по шкале Кельвина:
Т1 = 34,7 + 273,2 = 307,9 К; P1 = 200 мм рт. ст.;
Т2 = 49,9 + 273,2 = 323,1 К; P2 = 400 мм рт. ст;
Т3 =? P3 = 760 мм рт.ст.
Р е ш е н и е
Рассчитываем теплоту испарения по формуле (1.69) по известным температурам кипения Т1 и Т2 при соответствующих давлениях P1 и P2:
 .
.
Для определения Т3 найденное значение теплоты испарения, известную пару значений Т1, P1, а также величину P3 подставляем в формулу (1.68):

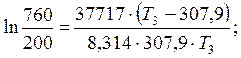
T3 · ln 3,8 = 14,734 · (T3 – 307,9);
1,335 Т3 = 14,734 Т3 – 4536,599; 13,399 · Т3 = 4536,599;
T3 = 338,58 K = 65,38 оС.
П р и м е р 1.23. При нормальном атмосферном давлении (P1 = 101325 Па) гексан кипит при температуре 69 оС. Определить мольную теплоту испарения гексана и давление насыщенного пара этого вещества при температуре 25 оС.
Р е ш е н и е
Температура кипения гексана при нормальном атмосферном давлении Т1 = 69 + 273,2 = 342,2 К. Т2 = 25 + 273,2 = 298,2 К. P2 =?
Гексан – неполярная жидкость, поэтому теплоту испарения рассчитываем, применяя правило Трутона, по формуле (1.74):
ΔHисп. = 89,12 · 342,2 = 30497 Дж/моль.
Для нахождения P2 найденное значение теплоты испарения, известную пару значений Т1 и P1, а также температуру Т2 подставляем в уравнение (1.68):

П р и м е р 1.24. Температура кипения бензола при давлении 1 атм равна 80,1 оС. Теплота испарения бензола составляет 31,1 кДж/моль. Чему равно давление насыщенного пара бензола при 25 оС?
Р е ш е н и е
Запишем исходные данные, присваивая параметрам соответствующие индексы и переводя температуру в градусы по шкале Кельвина:
Т1 = 80,1 + 273,2 = 353,3 К; P1 = 1 атм;
Т2 = 25 + 273,2 = 298,2 К; P2 =?
Подставим известные величины в уравнение (1.68), при этом теплота испарения должна быть выражена в Дж/моль:
 P2 = e–1,956 = 0,141 атм.
P2 = e–1,956 = 0,141 атм.
Растворами называются гомогенные системы, состоящие из двух и более компонентов, состав которых в определенных пределах может непрерывно изменяться. Различают газообразные, жидкие и твердые растворы. Растворы бывают идеальные (разбавленные и совершенные) и реальные. Состав растворов задается качественно и количественно.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2917; Нарушение авторских прав?; Мы поможем в написании вашей работы!