
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Из уравнений (1.51) и (1.52) следует, что в состоянии равновесия
|
|
|
|
Если в системе протекает обратимая химическая реакция
Химическое равновесие. Расчет констант равновесия обратимых химических реакций
При протекании обратимых химических реакций через некоторое время в системах устанавливается равновесное состояние – химическое равновесие.
aA + bB ↔ eE + dD, (1.48)
то при химическом равновесии скорости прямой и обратной реакций равны, а концентрации всех реагирующих веществ перестают меняться и остаются постоянными во времени при неизменных внешних условиях. Равновесие может быть достигнуто при протекании процесса в зависимости от состава системы, как в прямом, так и в обратном направлении (как слева направо, так и справа налево).
При протекании реакции в изобарно-изотермических условиях (P = const, T = const) для определения направленности процесса и состояния равновесия используется величина изменения свободной энергии Гиббса ΔG (изобарно-изотермического потенциала) для данной химической реакции. Часть изобарно-изотермического потенциала, приходящегося на один моль вещества, участвующего в реакции, называется химическим потенциалом данного вещества (μi) и выражается следующей производной:
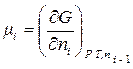 . (1.49)
. (1.49)
В состоянии равновесия свободная энергия Гиббса достигает своего минимального значения и не изменяется. Условие равновесия химической реакции: dG = 0. Так как dG = Σμi· dni, то в состоянии равновесия сумма химических потенциалов всех составляющих системы, умноженных на соответствующие стехиометрические коэффициенты, равна нулю:
Σμi· dni = 0, или (1.50)
eµE + dµD – aµA – bµB = 0. (1.51)
Химический потенциал каждого участника химической реакции является функцией активности ai этого компонента:
µI = µIo + RT lnai, (1.52)
где µIo – стандартный химический потенциал (при аi = 1);
ai – термодинамическая активность – величина, связанная в реальных системах с другими термодинамическим величинами так, как с ними связана концентрация в идеальных системах (ai = γi· ci, где γi – коэффициент термодинамической активности, зависящий от природы веществ, их концентрации и внешних условий).
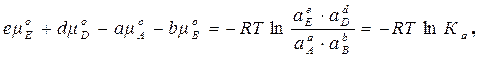 (1.53)
(1.53)
где  Ka – константа равновесия химической реакции, выраженная через равновесные активности веществ, участвующих в реакции:
Ka – константа равновесия химической реакции, выраженная через равновесные активности веществ, участвующих в реакции:
 (1.54)
(1.54)
Для идеальных систем константа равновесия может быть выражена через равновесные молярные концентрации сi:
 (1.55)
(1.55)
через равновесные парциальные давления Pi:
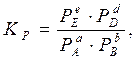 (1.56)
(1.56)
через равновесные мольные доли реагентов:
 (1.57)
(1.57)
Уравнения (1.54) – (1.57) отражают закон действующих масс для обратимых химических реакций, который читается следующим образом: при постоянных температуре и давлении отношение произведения равновесных концентраций (парциальных давлений) продуктов реакции к произведению равновесных концентраций (парциальных давлений) исходных веществ в степенях, равных соответствующим стехиометрическим коэффициентам, есть величина постоянная.
Чем выше константа равновесия, тем более глубоко протекает прямая реакция до наступления состояния равновесия.
Для идеальных газов Pi = ci RT и Pi = Ni P, где P – общее давление, поэтому представленные константы равновесия связаны следующим образом:
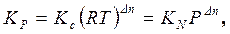 (1.58)
(1.58)
где Δn – изменение числа молей газообразных участников реакции.
Например, если все компоненты реакции (1.48) находятся в газовой фазе, то
Δn = (e + d) – (a + b). (1.59)
Для химических реакций, проходящих в изобарно-изотермических условиях, изменение энергии Гиббса при переходе системы из исходного неравновесного состояния в равновесное (химическое сродство) можно рассчитать по уравнению изотермы Вант-Гоффа:
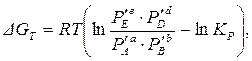 (1.60)
(1.60)
где 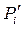 – неравновесные парциальные давления (в исходном состоянии) веществ, участвующих в реакции.
– неравновесные парциальные давления (в исходном состоянии) веществ, участвующих в реакции.
Рассчитанное по уравнению (1.60) значение ΔGT позволяет определить направление процесса: если ΔGT < 0, то самопроизвольно идет прямая реакция, если ΔGT > 0, то при данных парциальных давлениях компонентов самопроизвольно будет идти обратная химическая реакция. Если ΔGT = 0, то при данных 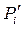 система находится в состоянии равновесия.
система находится в состоянии равновесия.
Если в исходном состоянии парциальные давления каждого реагента равны 1 ( = 1), то есть все вещества вступают в реакцию в своих стандартных состояниях, то на основании уравнения (1.60) может быть получено уравнение для расчета стандартной энергии Гиббса (стандартного химического сродства):
= 1), то есть все вещества вступают в реакцию в своих стандартных состояниях, то на основании уравнения (1.60) может быть получено уравнение для расчета стандартной энергии Гиббса (стандартного химического сродства):
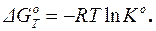 (1.61)
(1.61)
Уравнение (1.61) может быть применено для расчета стандартной константы равновесия:
 (1.62)
(1.62)
Методы расчета стандартных изменений энергии Гиббса при различных температурах (ΔGoT) приведены в главе 1.5.3.
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается таким образом, чтобы снизить эффект этого воздействия. А именно, повышение давления смещает равновесие обратимой химической реакции в сторону уменьшения объема (то есть в сторону уменьшения количества молей газа). Повышение температуры сдвигает равновесие в сторону реакции, протекающей с поглощением теплоты.
Количественно зависимость константы равновесия от температуры описывается для процесса, протекающего при постоянном давлении, уравнением изобары Вант-Гоффа:
 . (1.63)
. (1.63)
Анализ этого дифференциального уравнения показывает, что для эндотермических реакций (ΔHо > 0) c увеличением температуры константа равновесия увеличивается (равновесие смещается в сторону продуктов реакции), а для экзотермических реакций (ΔHо < 0) с увеличением температуры константа равновесия уменьшается (равновесие смещается в сторону  исходных веществ). Таким образом, эндотермические реакции целесообразно проводить при более высоких температурах, а для экзотермических процессов увеличению выхода продуктов реакции в равновесном состоянии будет способствовать понижение температуры.
исходных веществ). Таким образом, эндотермические реакции целесообразно проводить при более высоких температурах, а для экзотермических процессов увеличению выхода продуктов реакции в равновесном состоянии будет способствовать понижение температуры.
После определенного интегрирования уравнения (1.63) в пределах от 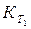 до
до 
 и от T1 до T2, принимая, что в данном температурном интервале тепловой эффект (изменение энтальпии ΔHo) не зависит от температуры, получим уравнение:
и от T1 до T2, принимая, что в данном температурном интервале тепловой эффект (изменение энтальпии ΔHo) не зависит от температуры, получим уравнение:
 , (1.64)
, (1.64)
которое позволяет по константам равновесия при двух температурах рассчитать тепловой эффект реакции или по известным величинам теплового эффекта и константе равновесия при одной температуре найти константу равновесия при другой температуре.
При определении оптимальных условий химических реакций необходимо учитывать не только термодинамические факторы, но и кинетические, технологические и экономические возможности процессов.
П р и м е р 1.17. Для химической реакции, проходящей в газовой фазе при Т = 1000 К:
4 HCl + O2 ↔ 2 H2O + 2 Cl2
рассчитать константы равновесия КР и КС, если равновесные парциальные давления (Н/м2 ) при температуре реакции составили:
PHCl =1,553·104; 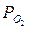 = 2,210·104;
= 2,210·104; 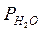 =
= 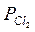 = 3,185·104.
= 3,185·104.
Р е ш е н и е
Для расчета Кр подставим известные равновесные парциальные давления реагирующих веществ в выражение закона действующих масс (1.56), записанного для данной химической реакции:
 Из соотношений (1.58) выражаем константу равновесия КС:
Из соотношений (1.58) выражаем константу равновесия КС:

∆ n находим по формуле (1.59):
∆ n = (2 + 2) – (4 + 1) = –1,
тогда
 м3/моль
м3/моль
П р и м е р 1.18. Определить константу равновесия при Т = 298 К реакции:
Al2O3 + 3 SO3 = Al2(SO4)3
корунд газ кр.
Таблица 1.11
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1367; Нарушение авторских прав?; Мы поможем в написании вашей работы!